慶應発サイエンス
記憶・学習のメカニズムを分子レベルで明らかに―記憶・学習を操作できるか
記憶や学習の場はシナプス
私たちがものを覚え、また練習によってさまざまなことが上手にできるようになるのは、なぜなのでしょうか。それは私たちの脳が、外部の刺激に対して変化してゆく器官であるからです。この変化可能な性質のことを、「可塑性」と呼んでいます。ニューロン(神経細胞)同士は、電気信号を用いることにより、お互いに情報伝達を行います。神経細胞は軸索と樹状突起という2種類の突起を持ちます。軸索を伝わった電気信号が、次のニューロンの樹状突起に電気信号を伝えるわけです。この軸索と樹状突起の接続している部位をシナプスと呼んでいます(図1)。
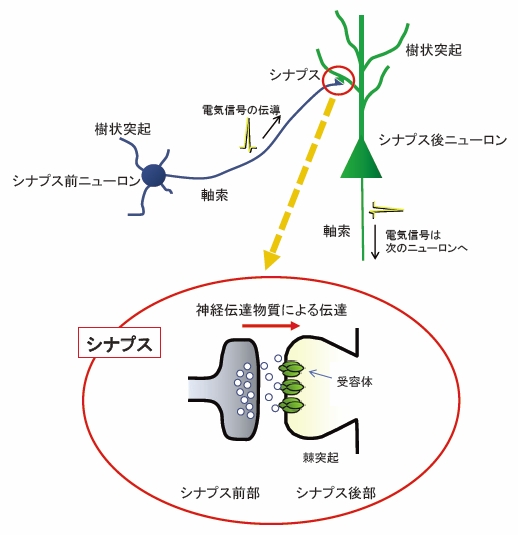
図1 シナプスの概念図
シナプス前ニューロンの電気信号が軸索の終末に達すると、電気信号がシナプス小胞に含まれる神経伝達物質の放出を促す。神経伝達物質はシナプスの間隙を拡散して、シナプス後ニューロンの樹状突起やその棘突起に存在する受容体に結合し、化学物質による信号が、再び、電気信号へと変換される。
面白いことに軸索と(次のニューロンの)樹状突起の間には20ナノメートル(1 mmの5万分の1程度)ほどの隙間があります。電気信号が軸索の終末部(シナプス前部)に到達すると、終末部から神経伝達物質が放出されます。この神経伝達物質が、次のニューロンの樹状突起や樹状突起上の棘(きょく)突起(シナプス後部)に存在する受容体に結合することにより、再び電気信号に変換されるわけです。
このようにシナプスは情報を伝達するために特化した構造です。では、なぜわざわざシナプスにおいて電気信号をいったん化学信号(神経伝達物質の放出)に変換し、もう一度電気信号に再変換するのでしょうか。その答えは、シナプスこそが記憶・学習のために必要な可塑性の場であるからです。
記憶・学習の形成過程では、シナプスでの情報の伝わりやすさ(シナプス伝達効率)が変化します。短・中期に持続する記憶・学習はシナプスに存在する分子の機能的な変化によっておきると考えられています。一方、より長期に持続する記憶・学習はシナプスの数や形態が変化する構造的な変化がおきるものとされています。このようなシナプスの機能と形態の可塑性は、さまざまな精神・神経疾患の病態とその治療過程にも関与しています。近年のヒトのゲノムの解析からは、シナプスに存在するタンパク質の遺伝子変異と精神疾患との関連が多く報告されています。さらに機能回復訓練や精神療法などの際にも、脳内ではシナプスの変化が生じているものと考えられます。実際に、シナプス関連分子の遺伝子を改変させたモデル動物では、シナプス可塑性の障害やさまざまな行動異常が観察されています。
私たちの研究室では、モデル動物を用いてシナプス可塑性やシナプス形成の分子メカニズムの研究を行っています。今回は私たちがマウスの小脳で明らかにした、Cbln1とGluD2という2つのシナプス可塑性を制御する分子の役割についてご紹介したいと思います。
運動学習とシナプス可塑性
小脳は大脳の後ろにある文字通り”小さな”脳です(図2A)。小脳に障害が起こると運動が上手にできなくなったり、バランスが障害されたりします。また近年では、運動だけではなく、高次の認知機能にも小脳が関与することが示唆されています。
運動に関係する記憶(例えば自転車に乗れるようになったり、ピアノが弾けるようになったりするような記憶)の形成には、小脳のプルキンエ細胞とそこへ入力する平行線維(顆粒細胞の軸索)との間のシナプスにおいて、神経伝達効率が長期にわたって低下することが極めて重要な役割を果たします(図2B、3)。このシナプス可塑性を長期抑圧(long-term depression; LTD)と呼びます。
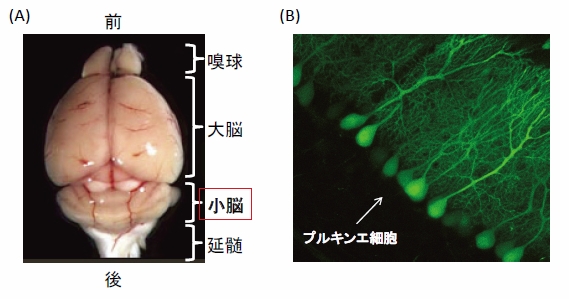
図2(A) マウスの脳を上(背側)から見た像。小脳の位置を示す。
図2(B) 小脳皮質の断面図。細胞の形を浮き上がらせるために、レンチウイルス・ベクターによって緑色に光る蛍光物質(GFP)の遺伝子を導入してあるので、プルキンエ細胞が光って見えている。
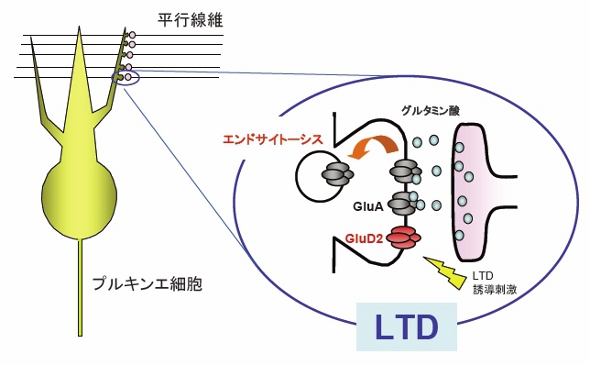
図3 小脳プルキンエ細胞と平行線維とのシナプスの長期抑圧(LTD)
LTDの誘導刺激が来ると、AMPA受容体(GluA)がエンドサイトーシスによって細胞内に取り込まれ、シナプス後部表面のAMPA受容体の数が減少する。これがLTDの分子レベルでの実体である。
ではLTDが起こるとき、分子レベルではどのようなことが起こっているのでしょうか。シナプスにおける神経伝達には興奮性と抑制性のものがあります。興奮性の神経伝達は、私たちの脳ではほとんどがグルタミン酸によって行われています。電気信号が軸索の終末部に到達すると、終末部からグルタミン酸が放出され、次のニューロンの棘(きょく)突起上に存在するグルタミン酸受容体に結合して、再び電気信号に変わるわけです。
グルタミン酸受容体にはいくつかのサブタイプがありますが、このうちAMPA受容体(GluAともいいます)が、スピードの速い神経伝達を担います。LTDが起こるときには、樹状突起上の棘突起の表面に存在するAMPA受容体が細胞内に一部取り込まれてしまいます。そのために軸索末端から同じ量のグルタミン酸が放出されても、樹状突起での電気信号が小さくなってしまい、神経伝達効率が減少すると考えられています。すなわちLTDとは、分子レベルでいうと、棘突起上のAMPA受容体の神経細胞内への取り込み(エンドサイトーシスといいます)現象なのです。
GluD2はLTDへの扉を開ける
LTDは小脳以外の脳部位でも起こる、普遍的なシナプス可塑性現象です。しかし小脳平行線維-プルキンエ細胞シナプスのLTDは、その誘導にデルタ2グルタミン酸受容体(GluD2)が必要である点で特別です。
GluD2はグルタミン酸受容体に分類されるものの、グルタミン酸が結合しません。そのためシナプス伝達にも直接関与せず、シナプスでのGluD2の存在意義は不明であり、長い間”孤児受容体”と呼ばれていました。ところが、GluD2をコードする遺伝子を欠損したマウスでは、LTDが障害され、運動失調や運動学習低下を示すことが分かりました。また興味深いことに、平行線維-プルキンエ細胞シナプスの数そのものも激減することも明らかになりました。つまり、GluD2は機能的(=LTD)のみならず形態的なシナプス可塑性において重要な役割を果たしていると考えられます。
ではGluD2は一体どのようにしてこの2つの機能を果たすのでしょうか。GluD2の機能の手がかりを得るために、私たちはさまざまな部位に変異を導入したGluD2を、GluD2欠損マウスのプルキンエ細胞に導入して、LTD障害および平行線維シナプス形成障害を回復させることができるかどうかを調べることにしました。面白いことに、GluD2の細胞内領域の一部を欠損した変異GluD2をプルキンエ細胞に導入すると、GluD2欠損マウスにおけるシナプス形成障害が回復しましたが、LTD障害は回復しませんでした。
一方、GluD2の細胞外領域の一部を欠損させた変異GluD2をプルキンエ細胞に導入するとLTD障害は回復しましたが、シナプス形成異常は回復しませんでした。この結果、機能的シナプス可塑性(=LTD)と形態的シナプス可塑性(平行線維シナプス形成)は、それぞれGluD2の別々の領域によって担われていることが明らかとなったわけです。
ではGluD2は細胞内領域を介してどのようにLTDを制御するのでしょうか。私たちは、GluD2の細胞内領域にはPTPMEGというチロシン脱リン酸化酵素が結合し、AMPA受容体のチロシン脱リン酸化を進めることを発見しました。GluD2欠損マウスやPTPMEG欠損マウスでは、AMPA受容体のチロシンリン酸化状態が亢進してしまい、そのためにAMPA受容体のエンドサイトーシスに必要な分子機構が進まないわけです(文献 1、図4)。
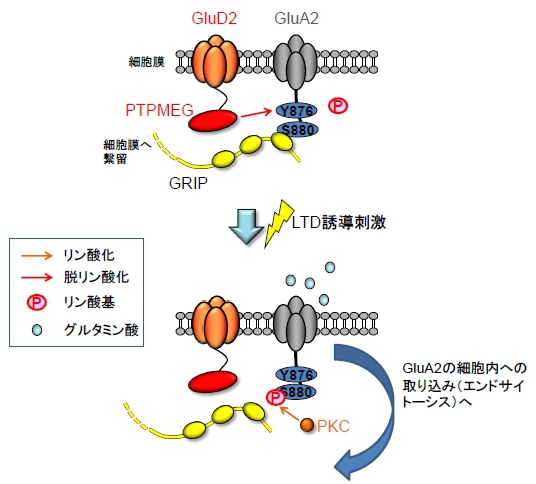
図4 GluD2のLTD誘導における細胞内機構
GluD2は、脱リン酸化酵素であるPTPMEGと結合し、一方、PTPMEGはAMPA受容体の一種であるGluA2の細胞内領域にあるチロシン残基(アミノ酸876番のチロシン;Y876)を脱リン酸化する。また、GluA2はGRIPというタンパク質との結合を介して、シナプス後部の細胞膜に繋留されている。LTD誘導刺激が与えられたときに、Y876が脱リン酸化状態にあると、GluA2のセリン残基(アミノ酸880番のセリン;S880)がプロテイン・キナーゼC(PKC)によってリン酸化される。S880のリン酸化はGluA2のGRIPからの解離を促し、シナプス後部への繋留から放たれて、GluA2はエンドサイトーシス過程へと進んでゆく。
D‐セリンは幼若期の運動学習を促進する
アミノ酸には光学異性体としてD‐アミノ酸とL‐アミノ酸があります。生物の中に多く存在するアミノ酸は、たんぱく質を構成しているL‐アミノ酸が主体ですが、D‐アミノ酸も神経伝達物質として使われることが分かってきています。GluD2にはグルタミン酸は結合しませんが、面白いことにD‐セリンが結合することが報告されました。小脳でもD‐セリンは幼若期に高濃度に存在し、成長につれて減少してゆくことが知られています。
そこで当教室の掛川らが、D‐セリンのシナプス可塑性への効果を検討したところ、D‐セリン存在下で平行線維を刺激すると、LTDが生じることを発見しました(文献2)。興味深いことに、D‐セリンはシナプスの周りを取り囲んでいるバーグマン・グリア細胞から分泌されていることも突き止めました。D‐セリンによるLTDもGluD2の細胞内領域が必要であることも分かっています。ただ先に述べたLTDとどこまで共通なメカニズムによっているのかは、今後さらなる研究が必要です。
また、D‐セリンが結合できない変異GluD2をプルキンエに発現する遺伝子改変マウスでは、正常のGluD2が発現するマウスに比べて、幼若期には運動学習の低下が見られました(図5)。D‐セリンは成熟後にはほとんど小脳では検出できなくなるため、D‐セリンによるGluD2を介した運動学習亢進効果は幼若期がメインであると考えられます。ただ、D‐セリンを外的に投与すると、成熟後であってもGluD2を介してLTDを引き起こすことができます。例えば高齢者の運動機能の衰えに対して、D‐セリンを小脳に補うことができるならば、機能改善の効果が見られるかもしれません。
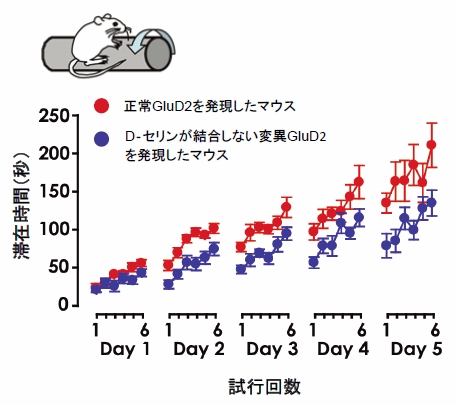
図5 D‐セリンの運動学習への効果
ローターロッドテストで、D‐セリンに結合しない変異型GluD2を発現した幼若期マウスの運動学習を評価した。ローターロッドテストとは、回転する棒にマウスを乗せ、棒上に滞在できる時間を測定する検査で、施行を繰り返すにつれて、学習効果によって滞在時間が長くなってゆく。変異型GluD2が発現するマウスの棒上の滞在時間(青丸)は、正常GluD2の発現するマウス(赤丸)に比べて短かった。このことは、変異GluD2を発現する幼若期のマウスは運動学習能力が低下していることを示している。
Cbln1はGluD2と結合してシナプス形成を誘導する
では、GluD2の細胞外領域はいったいどのようにしてシナプス形成に寄与するのでしょうか。私たちは、以前からその存在が知られていながら機能が不明であった、平行線維から分泌されるCbln(シービーエルエヌ)1というタンパク質に注目し、この欠損マウスがGluD2欠損マウスと酷似した表現型を示すことを発見しました。Cbln1は細胞外に分泌されるタンパク質なので、GluD2に結合して平行線維-プルキンエ細胞シナプスの形成を誘導するのではないかと考え、当教室の松田(恵)らが研究をさらに進めたところ、Cbln1はシナプス後部のGluD2とシナプス前部のニューレキシンというタンパク質にサンドウィッチのようにはさまれて結合して効果を発揮する、新しいシナプス形成分子であることが明らかとなりました(図6、文献3, 4)。
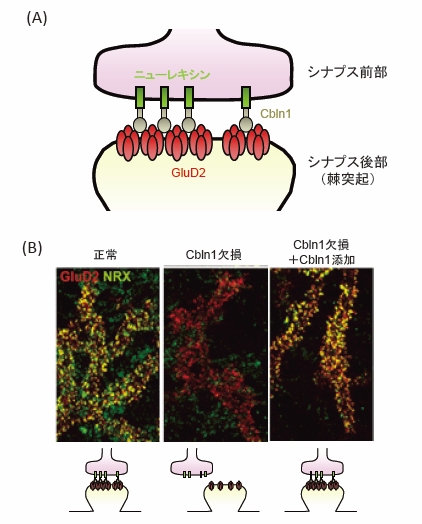
図6(A) Cbln1がシナプス前部のニューレキシンとシナプス後部のGluD2の両者に結合してシナプス形成をすることを示す概念図。
図6(B) Cbln1、GluD2、ニューレキシンの3者がCbln1を介して結合することを示唆する培養細胞系でのプルキンエ細胞の免疫組織像。シナプスを形成している正常プルキンエ細胞では、シナプス後部に存在するGluD2(赤色のドット)とシナプス前部のニューレキシン(NRX; 緑色のドット)がCbln1を介して結合しているので、それらが共局在して緑色と赤色が重なる結果、黄色のドットが数多く見える(左)。Cbln1欠損マウスのプルキンエ細胞では、GluD2とニューレキシンが共局在せず、緑色と赤色のドットが分離しているが(中央)、ここに精製Cbln1を外から加えてやると、正常プルキンエ細胞と同様に、共局在するようになる(右)。
Cbln1欠損マウスの小脳にCbln1を注入してやると、驚くべきことに、わずか数日で平行線維-プルキンエ細胞シナプスが回復し、運動の障害も回復します。ただ残念ながら、この効果は永続的ではなく、おそらくCbln1が分解されて失われるために、1週間ほどしか持続しませんでした。このようにCbln1は強力なシナプス誘導能を持つので、Cbln1-GluD2系は、将来、目的のニューロンにシナプスを人工的に作らせる技術に応用できるかもしれません。
おわりに
小脳でのシナプス可塑性とシナプス形成について述べてきましたが、実はGluD2やCbln1は小脳以外の脳部位でも発現しています。さらに、GluD2にはGluD1という同族分子があり、Cbln1にも他にCbln2~4が存在します。これらは脳の様々な部位に発現し、互いに結合することが知られています。従って、Cbln-GluD系は脳内で作動している普遍的機構と考えられます。また私たちは、GluD2の欠損がヒトで重篤な知能の障害を引き起こすことを発見しています(文献5)。Cbln-GluD系の機能のさらなる研究は、脳の可塑性のメカニズムを明らかにするとともに、脳の病態の解明にも繋がるものと私たちは期待しています。

左から、松田助教、柚崎教授、筆者、掛川講師
参考文献
- The δ2 glutamate receptor gates long-term depression by coordinating interactions between two AMPA receptor phosphorylation sites.
Kohda K, Kakegawa W, Matsuda S, Yamamoto T, Hirano H, Yuzaki M.
PNAS 2013 Mar 5;110(10):E948-57. doi: 10.1073/pnas.1218380110. Epub 2013 Feb 19.
http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3593918/
- D-Serine regulates cerebellar LTD and motor coordination through the δ2 glutamate receptor.
Kakegawa W, Miyoshi Y, Hamase K, Matsuda S, Matsuda K, Kohda K, Emi K, Motohashi J, Konno R, Zaitsu K, Yuzaki M.
Nature Neurosci. 2011 May;14(5):603-11. doi: 10.1038/nn.2791. Epub 2011 Apr 3.
http://www.nature.com/neuro/journal/v14/n5/abs/nn.2791.html
- Cbln1 is a ligand for an orphan glutamate receptor δ2, a bidirectional synapse organizer.
Matsuda K, Miura E, Miyazaki T, Kakegawa W, Emi K, Narumi S, Fukazawa Y, Ito-Ishida A, Kondo T, Shigemoto R, Watanabe M, Yuzaki M.
Science. 2010 Apr 16;328(5976):363-8. doi: 10.1126/science.1185152.
http://www.sciencemag.org/content/328/5976/363.abstract
- Presynaptically released Cbln1 induces dynamic axonal structural changes by interacting with GluD2 during cerebellar synapse formation.
Ito-Ishida A, Miyazaki T, Miura E, Matsuda K, Watanabe M, Yuzaki M, Okabe S.
Neuron. 2012 Nov 8;76(3):549-64. doi: 10.1016/j.neuron.2012.07.027.
http://www.sciencedirect.com/science/article/pii/S0896627312007167
- Deletions in GRID2 lead to a recessive syndrome of cerebellar ataxia and tonic upgaze in humans.
Hills LB, Masri A, Konno K, Kakegawa W, Lam AT, Lim-Melia E, Chandy N, Hill RS, Partlow JN, Al-Saffar M, Nasir R, Stoler JM, Barkovich AJ, Watanabe M, Yuzaki M, Mochida GH.
Neurology. 2013 Oct 15;81(16):1378-86. doi: 10.1212/WNL.0b013e3182a841a3. Epub 2013 Sep 27.
http://www.neurology.org/content/81/16/1378.abstract

