慶應発サイエンス
ヒトサイズに近いバイオ人工肝臓を使った移植実験に世界で初めて成功 ~臓器再生医療の実現化を加速~
研究の概要
古代から肝臓が高い自己再生能力を持つことが経験的に知られていますが、実際に日常的に医療現場でも肝切除後の容量や機能の回復を経験します。その高い再生力が臨床に最も生かされているのが生体肝移植といえます。健康なドナーに対して肝臓を60%以上摘出してもなお安全な医療として成り立つ生体肝移植は、国内だけで約500例が毎年行われています。この肝臓が持つ高い自己再生力は、他の臓器には類を見ない特徴であり、以前からその再生メカニズムの解明が肝臓のみならず、臓器再生そのものに重要な知見を与えるだろうと期待されてきました。
しかしながら、体外で再生に必要な体内環境を再現することは非常に困難であり、一旦体外環境に曝された肝組織は、再生・増殖をするどころか数時間機能を維持することもままなりません。成熟肝細胞についても、体外で増殖させることは非常に困難です。このような体内環境と体外での培養系における肝細胞・肝組織の性質の大きな違いは、肝臓を主に構成する肝細胞が細胞周囲環境に大きく依存した性格を持つ細胞であることを示しており、自己再生力を再現させるためには肝臓に関わる周囲環境や臓器間相互作用の適切な理解とその構築が必須であることを示唆しています。特に肝臓は胆汁の産生・排泄・循環という他の臓器にはない極めて特殊な機能と門脈血流を有しており、これには肝臓特有の三次元構造が大きく関与しています。
他の臓器にないこれらの特徴を持つ肝臓が複雑な機能を維持するためには、少なくとも次のような細胞周囲環境が重要な役割を担っていると考えられています。すなわち、1)複数細胞の立体配列を可能にする三次元骨格、2)局所に特異的な細胞外マトリックス(ECM)構成成分、3)末梢まで行き渡る門脈血流、4)門脈血流を通して供給される生理活性物質、です。我々はこれらの細胞周囲環境の各要素をすべて再現可能な基盤技術の一つとして、「脱細胞化臓器骨格」に着目し研究を進めてまいりました。本研究によって、特にブタ肝臓を使った脱細胞化骨格の意義がタンパク解析などによって検証され、脱細胞・再細胞化技術を大型システムで確立したうえで、移植可能な部分再生肝臓グラフトを完成させ、最終的に肝障害モデルブタへの移植を成功いたしました。この成果は、今後ヒトiPS細胞技術と融合することで、臓器レベルでの再生医療の実現化に繋がることが期待されます。
研究の背景
現在、末期肝不全の患者さんに対する唯一の治療法は移植治療しかありません。しかし、臓器提供者(ドナー)の慢性的な不足が問題となっていて、全世界で年間200万人以上の人々が肝臓疾患で亡くなられています。iPS細胞の発明以来、近年の再生医療技術の発展はめざましく、末期肝不全などの臓器不全の治療に大きな期待が寄せられていますが、ヒトiPS細胞を肝再生医療に応用するためには、他の部位や臓器とは異なる大型のスケールと複雑な機能を補い、体内に大量の細胞を立体的に生着させ、安定した機能を発現させる新しい技術開発が必須です。実際に過去の肝細胞自体を移植した臨床試験の結果、成熟した肝細胞を体外から複数回門脈または脾臓を経由して肝臓内部に注入しても永続的な肝機能の改善には至りませんでした(文献1)。また、国内に比べて脳死移植治療が確立している海外では、心停止時間が長い状態や摘出された臓器の質的な問題で、脳死移植ドナーに適さないと判断され廃棄される肝臓が実際に存在し、米国だけでも年間2万件を超えるといわれています。このようにドナーとして摘出した臓器を無駄にしないために、体外での臓器保存技術の開発が盛んに行われてきましたが、血流が途絶えた肝臓はわずか数時間で機能を停止し、その機能を復活させることが非常に困難であるため、ドナー不足の問題解決には至っていません。
再生医療実現化のための基盤技術の一つとして、また臓器保存のゴールデンタイムを過ぎてしまった肝臓を有効利用するための画期的な活用法の一つとして、臓器に対する「脱細胞化」の技術が2008年にラットの心臓を用いてボストンのグループから初めて報告され(文献2)、その後、 肝(文献3)・肺・腎臓など様々な臓器で同様の手法が実現可能であることが発表されたことで、この「臓器の脱細胞化」の有用性が認識され世界的な注目を浴びたといえます。本研究グループは、この再生医療技術の障壁であった「大きさのギャップ」を埋める革新的技術を開発するために、動物臓器から細胞を洗い流し、コラーゲンなどの有効成分だけを残す「脱細胞化」という方法に早くから着目し、このコラーゲンを主体とした臓器骨格構造を元にして、生きたブタの肝臓細胞を充填し、ヒトの大きさに近いバイオ人工肝臓を作製する技術を確立いたしました。さらにこの新しいバイオ人工肝臓を、肝臓障害を誘導したブタに移植したところ、移植後1か月間で肝臓障害を治療することに成功しました(図1)。
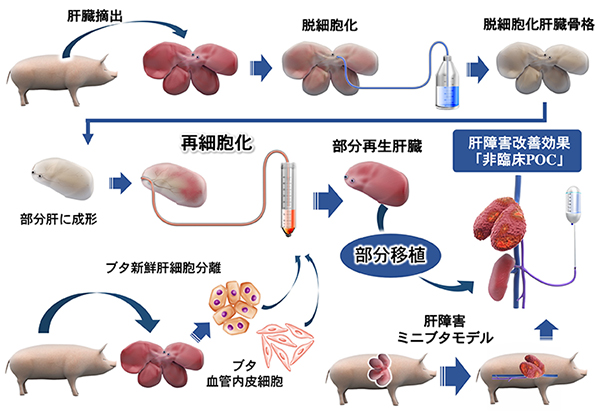
研究成果
まず、ブタの肝臓から細胞をすべて洗い流す「脱細胞化」処理のために界面活性剤などを使い効率的に有効成分である細胞外マトリックス(注1)などを残し、肝臓の骨格構造を維持する手法を確立いたしました(図2)。この手法を用いることで、新しく外部から細胞を注入して充填した際に、肝臓の骨格構造に細胞が生着しやすい環境を作り出すことが可能になりました。実際に「脱細胞化」処理を行った後で多くの細胞外マトリックス成分が残存し、肝臓内部の血管・胆管の構造が保たれていることが示されました。
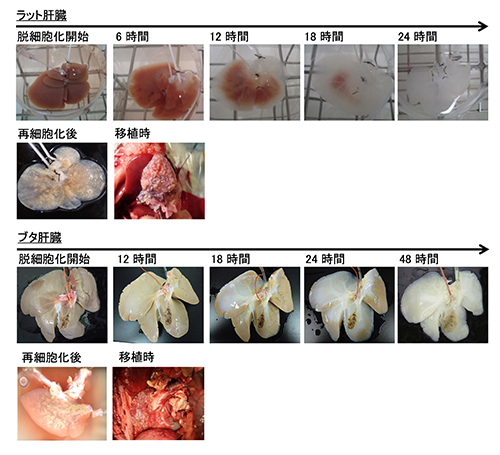
次にブタの肝臓細胞と血管内皮細胞を、「脱細胞化肝臓骨格」内部に血管から、注入する圧力を測定しながらゆっくりと充填していくことで、移植肝臓としての機能を果たすために必要とされる十分な数の肝細胞と、移植後の血栓化を防ぐのに十分な血管内皮細胞を生着させることに成功しました。細胞が充填された後、肝臓としての機能を測定すると、アルブミンや尿素、凝固因子という肝臓で作られる物質が検出され、また他の肝臓機能に重要な遺伝子であるCYP(注2)関連遺伝子の発現が上昇していることが確認されました。これらの検出結果は、体外でヒトの肝臓の大きさに近く、実際に肝臓機能を発現するバイオ人工肝臓の作製に成功したことを物語っています。
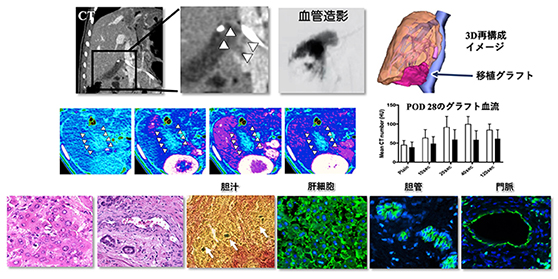
このバイオ人工肝臓の治療効果を証明するために、慢性肝不全に陥ったブタへ、このバイオ人工肝臓の血管を繋いで、体内へ移植したところ、1か月間で肝臓の治療効果を示すことに成功しました。移植されたブタは移植されなかったブタと比較して、特に移植後の早い日数で肝機能が改善していることが、各種の肝臓関連の血液検査データ(AST、ALT、ビリルビン、ALPなど)(注3-6)で確認されました。また移植手術後2週間目、1か月目に造影CTを撮影したところ、バイオ人工肝臓内部に血液の流入があることが確認されました(図3)。
研究の意義・今後の展開
ヒトに応用可能な大きさのバイオ人工肝臓を世界で初めて移植成功に導いた今回の成果は、今後の臓器再生医療の実現化に向けて、大きな進歩であるといえます。我々が用いている脱細胞化骨格のように生体由来の細胞外マトリックスを、立体構造を含めて丸ごと使用する試みはまだ始まったばかりであり、もしこの脱細胞化した三次元細胞外マトリックス構造を幹細胞培養・細胞/臓器移植の基盤技術として安定的に使用することができれば、幹細胞の体内における周囲環境に限りなく近い足場を提供することが可能となり、 これからの再生医療の発展に大きな役割を担うと考えられます。今回の結果はブタの細胞を使っていますが、同じ方法でヒトiPS細胞から作られた細胞を充填する研究も進められており、近い将来肝不全を治療できるヒトバイオ人工肝臓の完成とともに、他の臓器への応用も大いに期待されます。
【用語解説】
(注1)細胞外マトリックス
細胞外で組織を裏打ちする基底膜や、細胞間隙に存在する糖とタンパク質の複合体のこと。
(注2)CYP
チトクロムP450(CYP)のこと。薬物の代謝に関与する代表的な酵素で肝臓に最も多く存在するため、肝臓機能の指標となる。
(注3)AST
アスパラギン酸アミノトランスフェラーゼのこと。心臓の筋肉や骨格筋、肝臓に多く含まれる酵素で、心臓や肝臓などの臓器になんらかの障害があると、血液検査で上昇がみられる。
(注4)ALT
アラニンアミノトランスフェラーゼのこと。肝臓に多く含まれる酵素で、特に肝臓になんらかの障害があると、血液検査で上昇がみられる。
(注5)ビリルビン
古くなった赤血球内のヘモグロビンが壊れて作られる色素で、肝臓で胆汁に排泄される。肝臓や胆道に異常がある場合に、血液検査で上昇がみられる。
(注6)ALP
アルカリフォスファターゼのこと。肝臓、腎臓、腸粘膜、骨などで作られる酵素で、肝臓で処理される。肝臓や胆道に異常がある場合に、血液検査で上昇がみられる。
参考文献
Transplantation of bioengineered liver capable of extended function in a preclinical liver failure model.
Higashi H, Yagi H, Kuroda K, Tajima K, Kojima H, Nishi K, Morisaku T, Hirukawa K, Fukuda K, Matsubara K, Kitago M, Shinoda M, Obara H, Adachi S, Nishimura K, Natsume T, Tomi M, Soto-Gutierrez A, Kitagawa Y.
Am J Transplant. 2022 Mar;22(3):731-744. doi: 10.1111/ajt.16928.
【本研究に先行する参考文献】
- Treatment of the Crigler-Najjar syndrome type I with hepatocyte transplantation.
Fox IJ, Chowdhury JR, Kaufman SS, et al.
N Engl J Med. 1998 May 14;338(20):1422-6. doi: 10.1056/NEJM199805143382004. - Regeneration and orthotopic transplantation of a bioartificial lung.
Ott HC, Clippinger B, Conrad C, et al.
Nat Med. 2010 Aug;16(8):927-33. doi: 10.1038/nm.2193. - Organ reengineering through development of a transplantable recellularized liver graft using decellularized liver matrix.
Uygun BE, Soto-Gutierrez A, Yagi H, et al.
Nat Med. 2010 Jul;16(7):814-20. doi: 10.1038/nm.2170.


