慶應発サイエンス
非アルコール性脂肪性肝炎(NASH)における肝細胞がん発生リスク診断法の開発
研究の背景
非アルコール性脂肪性肝炎(NASH)は、大量飲酒や肝炎ウイルスへの感染といった原因がないにも関わらず、肝臓に脂肪が溜まって炎症が引き起こされ、その状態が長期間続くと肝硬変(注1)や肝細胞がん(注2)になるという病気であり、肥満・糖尿病・脂質異常症などと関連して発症するとされています。従来、大量飲酒や肝炎ウイルスに関連した肝障害や肝細胞がんが注目されていましたが、近年は日本を含めて世界的にNASHの患者さんが増加しており、NASHやNASHに関連した肝細胞がんが非常に注目されています。
早期に肝細胞がんを発見することが治療成績の向上に重要ですが、NASHに関連した肝硬変の患者さんを5年間経過観察している間に、さらに肝がんまで進行する頻度は約11%とされています(文献1)。そのためNASH患者さん全員に、肝がんの診断の画像検査などを行うために頻繁に病院を受診していただくことは難しい可能性があります。そこで、NASHから肝がんになるリスクを診断する有効なバイオマーカー(注3)を開発できれば、発がんリスク(注4)の高い患者さんを見つけて継続した病院受診をお願いし、画像診断などを繰り返すことで、肝がんを早期発見し治療成績を向上させられると考えました。
DNAメチル化とは、DNAに遺伝情報を書き込む暗号文を構成しているT(チミン)・C(シトシン)・G(グアニン)・A(アデニン)の4文字(塩基)のうち、シトシン塩基にメチル基が結合するDNAの飾り(修飾)のことであり、細胞の中で遺伝子からタンパク質が作られる量を調整する“エピジェネティック機構”の一つです。正常細胞ではメチル基が通常結合していないシトシン塩基に、新たにメチル基が結合してしまうようなDNAメチル化異常が、環境要因などにより生じます。それに伴って作られるタンパク質の量が変化し、様々な疾患発症につながります。発がん過程では、DNAメチル化異常によって、がん細胞の増殖などに関連する遺伝子の発現量が変化したり、細胞核中の遺伝情報を担う染色体が不安定な状態になったりします。このようにDNAメチル化の異常は重要な発がんの分子機構であり、がんの診断・治療・予防への臨床応用が試みられ、注目されている研究分野です。
研究の概要
肝組織検体を用いたゲノム網羅的DNAメチル化解析(図1)
研究に同意してくださった患者さんの手術検体のうち、患者さんご自身の診療のための病理診断を邪魔しない部位から、“正常肝組織”、“すでに肝細胞がんの発生母地になってしまったNASHの肝組織(発がんリスクのあるNASH検体)”、“NASHを背景にして起こった肝細胞がん組織”の3種類の組織を解析に用いました。研究に同意してくださったことで、患者さんが余分に痛い思いをすることなく、患者さんご自身の治療に不利益を被らないようにしました。また研究に同意してくださった患者さんと、そうでない患者さんの間で、治療に違いなどは一切ありません。各検体の病理組織像について顕微鏡を用いて厳密に観察したのち、“高密度ビーズアレイ”(注5)を使用してゲノム全体のDNAメチル化状態を網羅的に測定し、正常肝組織と発がんリスクのあるNASH検体を見分けることができるシトシン塩基を450か所見つけました。また、このような発がんリスク段階(前がん段階)のDNAメチル化異常は、NASH由来肝細胞がんに受け継がれていたことから、DNAメチル化状態を指標にして、NASH患者さんの発がんリスク診断ができるだろうと考えました。
そこで、すでに取得していた“NASHを発症しているが肝細胞がんにはなっていない患者さんの肝組織(発がんリスクの少ないNASH検体)”のデータと比較し、450か所のシトシン塩基の中から、発がんリスクマーカーとして特に有用な21か所を抽出しました。これらのシトシン塩基のDNAメチル化状態を測定すれば、顕微鏡所見のみでは予測しきれない発がんリスクを診断できると考えました。
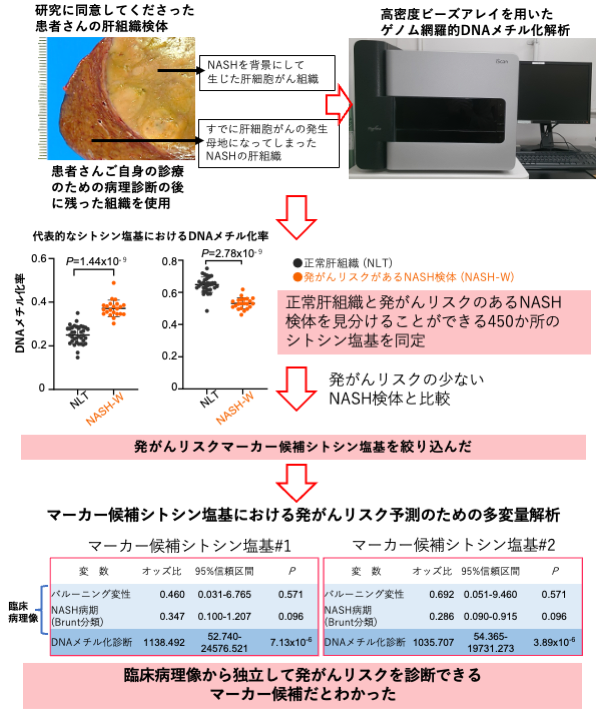
図1.肝組織検体を用いたゲノム網羅的DNAメチル化解析による発がんリスク候補シトシン塩基の同定
NASH患者さんの発がんリスク診断法の医療実装に向けた開発(図2)
ゲノム全体のDNAメチル化状態を網羅的に測定する“高密度ビーズアレイ”などを用いる大型測定機器は、研究を目的として多数の検体を効率的かつ網羅的に測定することには向いていますが、診療を目的としてお一人おひとりの患者さんの検体を個別に測定するのには適していません。また、患者さんの組織検体中には、肝細胞のみならず炎症細胞や血管内皮細胞などの多種類の細胞が混在しているので、臨床検査として測定を行うには、多種類の細胞のDNAメチル化状態を区別できる手法が求められます。そこで、多種類の細胞が混在した臨床検体のDNAメチル化状態を短時間で精密に測定できるアニオン交換高速液体クロマトグラフィー法(注6:anion-exchange high-performance liquid chromatography、以下HPLC)(文献2)を、以前に企業と共同で開発していました。
バイオマーカーの探索に用いた患者さんとは別の患者さんの組織検体を用い、このHPLC法にて発がんリスク診断の信頼度を検証したところ、高い再現性を示すことが分かりました。HPLC法での測定に特に適した3か所のシトシン塩基のDNAメチル化状態を調べることにより、すでに肝細胞がんの発生母地になってしまった肝組織検体を、95%の感度で “発がんリスクあり(陽性)”と正しく診断することができました。また、まだ肝細胞がんの発生母地になっていない少数のNASH検体なども発がんリスクありと判定されましたが、これは単なる偽陽性ではなく、適切な介入予防などを行わなければ肝細胞がんになってしまう症例である可能性を否定できません。
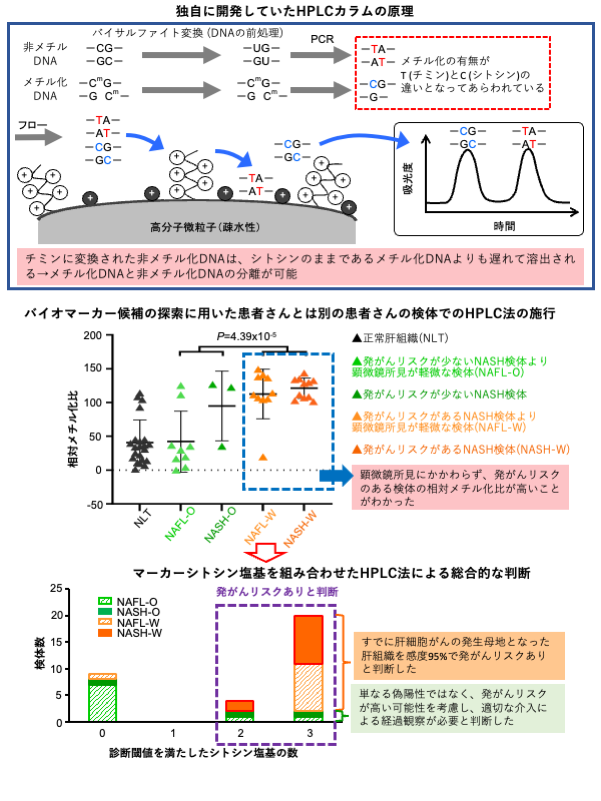
図2.独自に開発していた高速液体クロマトグラフィー(HPLC)法を用いた、バイオマーカー候補を探索した検体とは別の患者さんの検体での検証
本研究の成果と意義・今後の展開
本研究では、独自に開発したHPLC法を用いたDNAメチル化状態の測定に基づき、NASH患者さんの経過観察中における肝細胞がん発生リスク診断バイオマーカー候補を同定しました。この発がんリスク診断法は、NASHの病理診断を行うために実施する肝生検検体の一部を用いて実施できると考えています。この発がんリスク診断法が普及すれば、肝細胞がんを早期に診断したり、NASHの進行を抑制する治療を早期に行うことで、治療成績向上と予後改善につながることが期待されます。さらに、本研究は日本人を対象とした研究成果であるため、他の人種においても有用であるか検証したのち、DNAメチル化診断を世界にも普及させたいと考えています。
【用語解説】
(注1)肝硬変
慢性肝炎の持続によって、肝細胞の壊死と再生を繰り返すうちに線維成分が増加し、線維成分で取り囲まれた再生結節が肝臓全体を占めている状態。肝細胞は本来の機能を果たせなくなり、肝硬変を背景に肝細胞がんが発生することがある。
(注2)肝細胞がん
肝臓を構成している肝細胞を母地として発生する上皮性悪性腫瘍であり、肝がんの90%以上を占めるとされている。我が国では、B型・C型肝炎ウイルス感染による慢性肝炎・肝硬変を背景に生じる肝細胞がん症例が従来優勢だが、近年はNASH・NASH関連の肝硬変などを背景に生じる肝細胞がん症例が増加している。
(注3)バイオマーカー
「通常の生物学的過程、病理学的過程、もしくは治療的介入に対する薬理学的応答の指標として、客観的に測定された評価される特性」と定義されている(Clin Pharmacol Ther 69: 89-95, 2001)。本研究では、「NASH患者さんにおける、肝細胞がんの発生リスクを診断できるバイオマーカー」の開発を目指している。
(注4)発がんリスク
将来がんになる危険性がある状態のことを指す。本研究では、がんの発生母地となりうるNASHで、すでにDNAメチル化異常が生じており、その異常が肝細胞がんの発生リスクを予測するバイオマーカーとして臨床的に有用であることに着目している。
(注5)高密度ビーズアレイ
ゲノム全体の分子情報を網羅的に取得するための解析基盤のうちの一つ。本研究では、メチル化DNAと非メチル化DNAを検出するプローブが多数植え付けられたマイクロビーズを高密度でガラス基板上に収容したアレイを指す。前処理を行ったDNAとマイクロビーズ上のプローブが結合し複合体を形成することで、DNAメチル化情報を取得する。
(注6)高速液体クロマトグラフィー(HPLC)法
分析したい試料を含む移動相(溶離液)を固定相(微粒子)が充填されたカラムの中に流し、固定相と移動相の相互作用の差を利用して試料中の成分を分離・検出する方法。本研究では、独自に開発したアンモニウムカチオンと疎水性部位を有する微粒子を充填したカラムを用い、前処理を行ったメチル化されたDNA断片とメチル化されていないDNA断片の、化学構造の差に基づくカラム充填剤との相互作用の差を利用し、両者を分離して定量する。
参考文献
Quantification of DNA methylation for carcinogenic risk estimation in patients with non-alcoholic steatohepatitis.
Kuramoto J, Arai E, Fujimoto M, Tian Y, Yamada Y, Yotani T, Makiuchi S, Tsuda N, Ojima H, Fukai M, Seki Y, Kasama K, Funahashi N, Udagawa H, Nammo T, Yasuda K, Taketomi A, Kanto T, Kanai Y.
Clin Epigenetics. 2022 Dec 5;14(1):168. doi: 10.1186/s13148-022-01379-4.
【本研究に先行する参考文献】
- Hepatocarcinogenesis in non-alcoholic fatty liver disease in Japan.
Tokushige K, Hashimoto E, Kodama K.
J Gastroenterol Hepatol. 2013 Dec;28 Suppl 4:88-92. doi: 10.1111/jgh.12239. - Novel method for DNA methylation analysis using high-performance liquid chromatography and its clinical application.
Yotani T, Yamada Y, Arai E, Tian Y, Gotoh M, Komiyama M, Fujimoto H, Sakamoto M, Kanai Y.
Cancer Sci. 2018 May;109(5):1690-1700. doi: 10.1111/cas.13566.

