慶應発サイエンス
DNAメチル化解析による脊髄移植後の腫瘍化の原因解明
研究の背景
我が国における脊髄損傷患者は10万人以上に達し、さらに毎年新たに約5千人が発症しています。しかし、患者さんの損傷した脊髄そのものを修復し、失われた機能を改善させる治療法は未だ確立されておりません。この状況を打開するために、全世界的に脊髄再生の研究が進められてきており、当研究室では、これまでにヒトiPS細胞から神経幹/前駆細胞(以下、iPSC-NS/PCs) を作製し、脊髄損傷モデル動物に対して細胞移植治療を行うことで運動機能が回復することを報告してきました(Tsuji 2010, Nori 2011, Kobayashi 2012)。しかし、これまでにごく一部のiPSC-NS/PCs株では移植後に腫瘍を形成してしまうことが明らかとなっています。
これまでにも未分化細胞・iPS細胞の残存によるものと考えられる奇形腫の形成が報告され、腫瘍化の主たる原因であるとされてきました。しかし、さらなる病理組織学的検討で、奇形腫とは異なる神経原性腫瘍が観察され、現在、安全性評価基準の一つとされている未分化細胞・iPS細胞の混入率だけでは、腫瘍ができる危険性(造腫瘍性)の評価基準として不完全であることが分かっています。
本研究は、DNAメチル化解析により、造腫瘍性を認めるhiPSC-NS/PCs(253G1-NS/PCs)と造腫瘍性を認めない安全なhiPSC-NS/PCs(201B7-NS/PCs)を解析し、腫瘍化する細胞株に起きたDNAメチル化異常を評価するとともに、安全な細胞株を選定する方法を検討する目的で行われました。
DNAメチル化とは
遺伝子転写(DNAからRNAが作られること)は、様々な方法で厳密に調節されており、体の中で過剰に遺伝子が発現してしまったり、逆に抑制されすぎないような仕組みが整っています。転写を制御する一つの方法として、「DNAメチル化」があります。
DNAの特殊な位置へのメチル基の付加反応のことを「DNAメチル化」と呼びます。DNA鎖の中で、転写が開始する場所の近傍がDNAメチル化されている場合には、その近くの遺伝子の転写が抑制されます。逆に、転写開始付近がDNAメチル化されていない場合には、その近くの遺伝子の転写が行われます(図1)。
近年、このDNAメチル化の異常が様々ながんで認められることが明らかとなっており、特にがん抑制遺伝子におけるDNAメチル化高値(=がん抑制遺伝子が正常に働かなくなること)が起こっていることが分かっています。
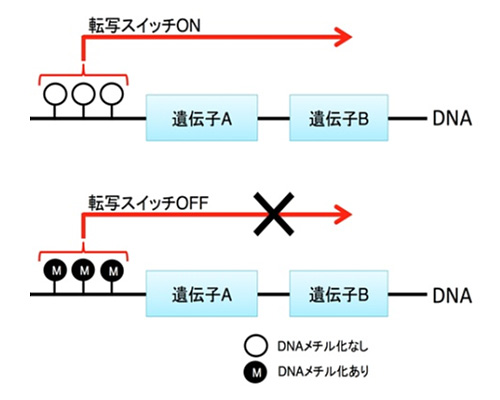
図1.DNAメチル化の仕組み
腫瘍性を認める細胞株(253G1-NS/PCs)におけるDNAメチル化異常
造腫瘍性を認める細胞株(253G1-NS/PCs)では、安全な細胞株(201B7-NS/PCs)と比較して、3つの腫瘍抑制遺伝子(CAT、PSMD5、RBP1)の転写開始地点付近の高メチル化が認められました。さらにこれらの遺伝子の遺伝子発現(RNAの量)を比較すると、253G1-NS/PCsでは低いことも分かりました。
次に、これらの遺伝子の発現が、iPSC-NS/PCsにおける造腫瘍性に影響を与えることを証明することとしました。人工的に作成したウイルスを用いた方法で、253-NS/PCsでこれら3つの遺伝子をそれぞれ強制的に高発現させたところ、253G1-NS/PCsの細胞増殖が有意に抑えられることが分かりました。この結果から、これら3つの腫瘍抑制遺伝子がDNAメチル化によって抑えられてしまうと、iPSC-NS/PCsの腫瘍化が促進されてしまうことが示唆されました。
iPSC-NS/PCsの継代によるDNAメチル化および遺伝子発現の変化
さらに、iPSC-NS/PCsの継代数を重ねた(=細胞株の培養を続けていった)時の変化を調べました。
上述したPSMD5という腫瘍抑制遺伝子については、継代数が低い時は安全な細胞株(201B7-NS/PCs)においては低メチル化を認めていましたが、18継代目になると高メチル化を呈することが分かりました。また、造腫瘍性を認める細胞株(253G-NS/PCs)についても、継代数が高くなるにつれて、腫瘍抑制遺伝子の高メチル化が進んだり、腫瘍化のシグナルの上昇が認められました。
これらの結果から、安全な細胞株においても、移植前の細胞の継代数を低く抑えることは、安全性の観点から重要であることが明らかとなりました(図2)。
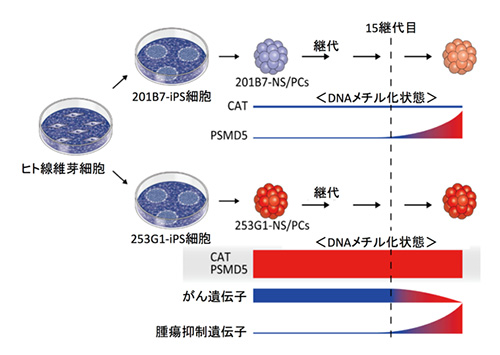
図2.細胞の継代によるDNAメチル化状態の変化
(参考文献のFigure.7より一部改変)
今後の展望
iPS細胞やiPSC-NS/PCsの作製方法が新たに改変されてきたことで、腫瘍化のリスクはここ数年で格段に低くなりましたが、腫瘍化対策を万全にすることは臨床研究を進めていく上で重要となります。
今回の結果から、DNAメチル化の変化がiPSC-NS/PCsにおける腫瘍化に少なからず関連している可能性や、移植細胞の継代数を検討することの重要性が示されましたが、一部の細胞株で腫瘍化が起こってしまう根本的な原因までは分かりませんでした。
現在、我々はDNAメチル化解析以外にも、次世代シークエンサーやマイクロアレイを駆使して様々な解析を網羅的に行っており、より安全な細胞移植治療を患者さんに提供できるよう腫瘍化の原因を解明すべく日々研究しています。
参考文献
Whole-Genome DNA Methylation Analyses Revealed Epigenetic Instability in Tumorigenic Human iPS Cell-Derived Neural Stem/Progenitor Cells.
Iida T, Iwanami A, Sanosaka T, Kohyama J, Miyoshi H, Nagoshi N, Kashiwagi R, Toyama Y, Matsumoto M, Nakamura M, Okano H.
Stem Cells. 2017 May;35(5):1316-1327. doi: 10.1002/stem.2581. Epub 2017 Feb 23.

左:筆者、右:中村雅也整形外科学教室教授

