慶應発サイエンス
腸管免疫の恒常性における腸内細菌の役割
はじめに
人間の消化管には常に100兆個以上の腸内細菌が生息しており、腸内細菌が免疫のバランスを取ることで恒常性を生み出す要因であると考えられています(図1)(文献1,2)。腸内細菌に対する免疫反応の異常は、潰瘍性大腸炎やクローン病などの炎症性腸疾患と呼ばれる消化管粘膜に炎症を生じる病気の原因になるということで注目されています。炎症性腸疾患は、厚生労働省により「特定疾患」に指定されている難病であり、就学・就労を控えた20歳代を中心に発症し、国内の患者数が約16万人を超えたことから、社会的にも大きな問題となりつつあります。そして、その原因の解明と治療法の確立が望まれています。また、腸内細菌はアレルギーのほか糖尿病や肥満、自閉症など様々な疾患との関連が示唆されています。
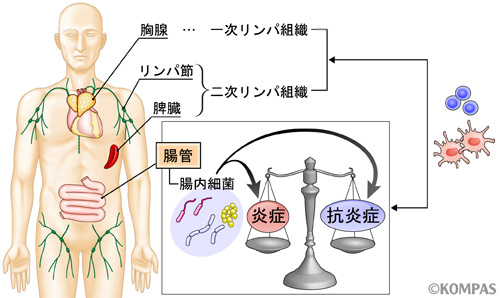
腸内には多数の腸内細菌が共生しており、常に炎症反応と抗炎症反応の間でバランスが保たれています。これらは生体防御に重要な反応ですが、このバランスが崩れることで様々な重篤な疾患が引き起こされてしまいます。
消化管免疫におけるクロストリジウム属細菌の役割
消化管免疫において制御性T細胞(Treg)は主要な役割を果たしています。特に、消化管のT細胞は、強力な抗炎症作用を持つサイトカインと呼ばれる物質の一つであるTGF-βによって誘導される誘導性Treg(iTreg)であることが報告されています。また、iTregは腸内細菌によって誘導されますが、特にクロストリジウム属の細菌がiTreg細胞を誘導することが近年の研究により明らかとなっています(文献3,4,5)。
しかしクロストリジウム属細菌がどのようなメカニズムでiTregを誘導するのかは解明されていませんでした。クロストリジウム属細菌が産生する酪酸のような短鎖脂肪酸がiTregを増加させることは知られていますが(文献6)、短鎖脂肪酸だけではiTregは誘導することができずTGF-βの存在が不可欠です。そこで我々はクロストリジウム属細菌がTGF-βの発現を誘導することでiTregを増加させているという仮説を立て、クロストリジウム属細菌の中の一つであり、善玉菌プロバイオティクスとして知られるC. butyricumを用いることでiTreg誘導における腸内細菌の新たな役割を解明しました。
C. butyricumはTGF-βの分泌機構を解して腸炎を抑制する
C. butyricumとTGF-β、及びiTreg細胞の相関性を示すために、我々はC. butyricum を経口投与したマウスに対してデキスラン硫酸(DSS)により誘導し腸炎を発症させる実験モデルを用いてその効果を検証しました。既に報告されてきた通りC. butyricumはDSS腸炎を軽減させ(文献7)、腸管粘膜固有層において炎症性サイトカイン (IL-12, TNF-α, IL-6)の発現を減少させました。そして、逆に、抗炎症性サイトカインであるIL-10及びTGF-βの発現を上昇させることが分かりました。さらにC. butyricumは腸管でiTregを増加させていました。このとき、腸管では抗原を提示する機能をもつ重要な免疫細胞である樹状細胞とC. butyricumの菌体成分であるペプチドグリカンが接触することによりTGF-βが分泌されており、Toll様受容体2 (TLR2)を介していることが明らかになりました(図2)。
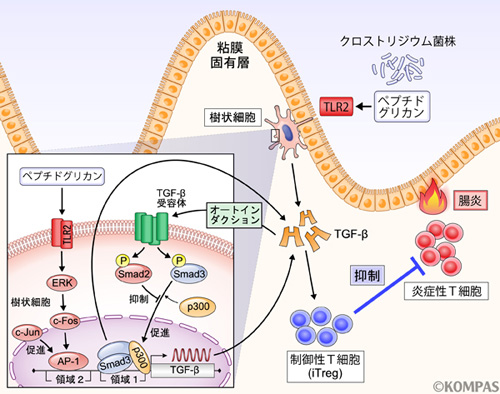
グラム陽性菌であるクロストリジウム属菌(C. butyricum)は、その膜主要成分であるペプチドグリカンによりTGF-βの分泌を促します。さらに、分泌されたTGF-βはTGF-β受容体からのシグナルを介してSmad2により負の制御を、Smad3により正の制御を受けることでその分泌がコントロールされています。
TGF-βの自己分泌にはSmad3が重要でSmad2は抑制に働く
さらに我々は、TGF-β受容体阻害剤の作用によりTGF-βの発現が低下することに注目し、分泌されたTGF-βによる刺激によりさらにTGF-βの発現を誘導していることを予想しました。そこでTGF-β受容体の下流の転写因子であるSmad2及びSmad3に着目し、Smad2及びSmad3が欠損した樹状細胞におけるTGF-βの分泌量を比較したところ、Smad2欠損樹状細胞では産生量が上昇し、逆にSmad3欠損樹状細胞では低下することが分かりました。すなわちTGF-βの産生制御においてSmad3は正の、Smad2は負の制御を担っていることが分かったのです。
また、Smad2欠損樹状細胞はTGF-βを過剰に産生するためiTreg細胞を強く誘導する可能性が考えられました。そこでSmad2を欠損させたマウスを作製し検証したところ、腸管でiTregが増加しておりDSS誘導性腸炎に抵抗性を示しました。さらにこのマウスから採取したSmad2欠損樹状細胞を詳細に解析したところ、炎症性サイトカインの分泌能が低下しており、T細胞を活性化させる分子の発現やMHC class II分子の発現も低下していることが分かりました。試験管内でのiTreg誘導系でもSmad2欠損樹状細胞はiTreg誘導能が亢進していました。さらに、T細胞やB細胞を持たないRag2欠損マウスに、ナイーブT細胞とSmad2欠損樹状細胞を同時に移入すると腸炎の症状が緩和されることが分かりました。
おわりに
近年腸内細菌叢の乱れ(撹乱;dysbiosis)が様々な疾患に関連することが指摘されています。このようなdysbiosisを改善する方法として乳酸菌などの善玉菌として知られるプロバイオティクスを用いた治療法が注目されています。本研究で明らかとなったC. butyricumやSmadによるTGF-βおよびiTregの誘導メカニズムは炎症性腸疾患に対するより安全で安価な治療法、予防法の開発につながることが期待されます。
参考文献
Smad2 and Smad3 Inversely Regulate TGF-β Autoinduction in Clostridium butyricum-Activated Dendritic Cells.
Kashiwagi I, Morita R, Schichita T, Komai K, Saeki K, Matsumoto M, Takeda K, Nomura M, Hayashi A, Kanai T, Yoshimura A.
Immunity. 2015 Jul 21;43(1):65-79. doi: 10.1016/j.immuni.2015.06.010. Epub 2015 Jun 30.
http://www.sciencedirect.com/science/journal/10747613/43/1![]()
【本研究に先行する参考文献】
- Hill, D.A., and Artis, D. (2010). Intestinal bacteria and the regulation of immune cell homeostasis. Annu. Rev. Immunol.28, 623-667.
- Hooper, L.V., Littman, D.R., and Macpherson, A.J. (2012). Interactions between the microbiota and the immune system. Science336, 1268-1273.
- Ivanov, I.I., and Honda, K. (2012). Intestinal commensal microbes as immune modulators. Cell Host Microbe12, 496-508.
- Atarashi, K., Tanoue, T., Shima, T., Imaoka, A., Kuwahara, T., Momose, Y., Cheng, G., Yamasaki, S., Saito, T., Ohba, Y., et al. (2011). Induction of colonic regulatory T cells by indigenousClostridiumspecies. Science331, 337-341.
- Atarashi, K., Tanoue, T., Oshima, K., Suda, W., Nagano, Y., Nishikawa, H., Fukuda, S., Saito, T., Narushima, S., Hase, K., et al. (2013). Treg induction by a rationally selected mixture of Clostridia strains from the human micro-biota. Nature500, 232-236.
- Furusawa, Y., Obata, Y., Fukuda, S., Endo, T.A., Nakato, G., Takahashi, D., Nakanishi, Y., Uetake, C., Kato, K., Kato, T., et al. (2013). Commensal microbe-derived butyrate induces the differentiation of colonic regulatory T cells. Nature 504, 446-450.
- Hayashi, A., Sato, T., Kamada, N., Mikami, Y., Matsuoka, K., Hisamatsu, T., Hibi, T., Roers, A., Yagita, H., Ohteki, T., et al. (2013). A single strain of Clostridium butyricum induces intestinal IL-10-producing macrophages to suppress acute experimental colitis in mice. Cell Host Microbe13, 711-722.

左:筆者、右:吉村昭彦(教授)

