慶應発サイエンス
アミロイドPET検査とタウPET検査の併用により認知症診療の診断、治療が大きく改善する可能性
認知症とは
世界の認知症患者は、2019年の推定5,740万から2050年には推定1億5,280万に増えると予測されています。特に、我が国では65歳以上の約1割が認知症と報告されており、日本の人口構成の高齢化に伴い増加する認知症の医療は、21世紀の大きな課題と考えられています。一方、働き盛りの40歳代から発症する若年性認知症も近年注目され、生活基盤の崩壊、長期介護の必要性から大きな社会問題となっています。
現在、認知症の最大原因であるアルツハイマー病(注1)は、認知症全体の6割以上を占めるといわれています。一般には、記憶障害で発症し、確実に進行することで見当識障害(注2)の出現や理解判断力の低下がみられます。アルツハイマー病の症状はゆっくりと進み、症状が出てから約半数が寝たきりとなるまでが約5±3年、死亡までの平均罹病期間は約8~10年で、一般に発症時の年齢が若いほど進行が早いといわれています。これまで、アルツハイマー病の根本治療薬の開発は難渋を極めていましたが、2021年6月米国でアルツハイマー病では初めてとなる疾患修飾薬が迅速承認され、大きな注目を集めています。
アルツハイマー病の診断
アルツハイマー病の確定診断には、2つの病因物質、アミロイドベータとタウ蛋白が脳に異常蓄積していることを確認しなくてはなりません(図1)。これらの病因物質を確認するためには、脳の一部を外科的に採取して顕微鏡で観察すること、すなわち病理検査が必要です。しかし、身体的負担が極めて高く実際に行われることはほとんどありません。現在、認知症の診断には、神経心理検査(記憶や注意力など認知機能を評価する)、頭部MRI(脳の萎縮の程度を診る)、脳血流検査(脳の血の巡りを評価する)などを行い総合的に判断します。ただし、どれも決定的な検査ではなく、誤診率は2~4割あるといわれています(文献1)。この誤診率の高さが、適切な治療、介護の選択に大きな障壁となっていました。
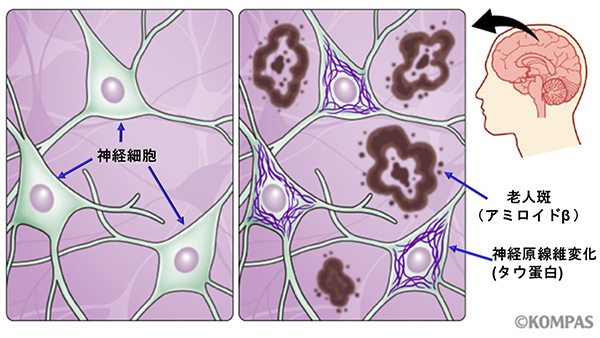
図1.アルツハイマー病脳内のアミロイドβとタウ蛋白の蓄積
アルツハイマー病の原因は、ベーターアミロイドとタウ蛋白と呼ばれる蛋白質のゴミが脳の中にたまることにより、神経細胞が障害されるためと考えられています(図2)。一方、この2つのゴミが揃って脳の中にたまっていなければ、アルツハイマー病ではありません。高齢者の多くの方はこれらのゴミが年とともに少しずつ脳に蓄積してきます。アルツハイマー病の方は、ゴミの蓄積が通常より多いため症状が生じると考えられています。
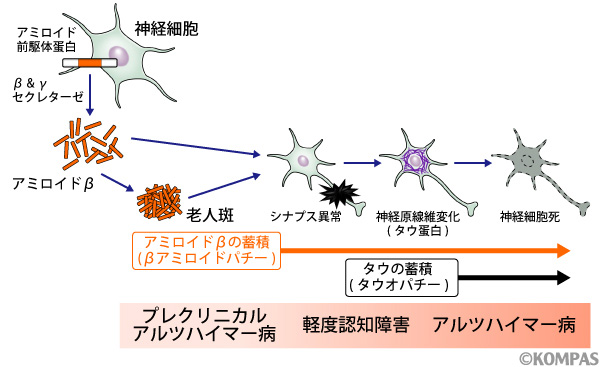
図2.アルツハイマー病のメカニズム -アミロイドカスケード仮説-
アミロイドPET検査とタウPET検査
慶應義塾大学病院メモリーセンターと量子科学技術研究開発機構からなる研究チームは、認知症患者、健常ボランティアにアミロイドPET検査(注3)([18F]florbetaben PET)とタウPET検査([18F]Florzolotau PET)(図3)を施行し、認知症専門医による臨床診断、治療、管理(検査、他診療科へのコンサルテーション、リハビリテーションの追加)をPET検査前後で比較しました。これまで、アミロイドPET検査の認知症診療に対する有効性を調査した報告はありましたが、近年開発されたタウPET検査(文献2)の有効性を評価した研究はありませんでした。このタウPET検査は、アルツハイマー病以外の認知症(前頭側頭葉認知症、パーキンソン症候群など)の診断にも有用であると期待されています。
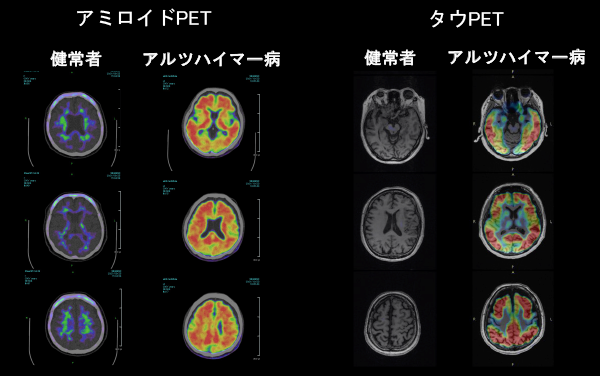
図3.アミロイドPET検査とタウPET検査
アルツハイマー病患者さんでは、アミロイドとタウの蓄積(黄-赤)が観察される。
その結果、107名の研究協力者[認知機能正常者(40名)、軽度認知障害(25名)、認知症(42名)]のうち、診断を変更したのは、認知機能正常者で25.0%、軽度認知障害で68.0%、認知症で23.8%でした。PET検査前後での全体的な管理変更は、認知機能正常者で5.0%、軽度認知障害で52.0%、認知症で38.1%でした。投薬の変更は、軽度認知障害で24.0%、認知症で19.0%でした。ロジスティック回帰分析により、タウPETはアミロイドPETよりも治療、管理の変更と強い関連性をもつことが明らかになりました。
本研究により、アミロイドPET検査とタウPET検査を組み合わせることで認知症患者の診断・治療が大きく変更し、特にタウPET検査は認知症診療の改善に貢献する可能性が示唆されました。
今後の展望
我が国の急速な高齢化に伴い、画期的な治療法・予防法が出現しない限り認知症患者の数は急速に増加し続けると考えられています。このPET検査は、経時的に検査値の推移を観察することにより認知症の新規治療薬開発にも応用できる可能性があります。
さらに今回の研究では、認知機能正常の高齢者の中でも25%の方が2つの病因物質(アミロイドベータとタウ蛋白)のどちらかもしくは両方が既に脳に蓄積していることが分かりました。つまり、この方々は、将来認知症になりうるリスクをもった方々といえます。したがって、このPET検査は、発症前診断、予防法の確立にも利用できると考えられます。
近年注目されているアルツハイマー病の根本治療薬においても、その投与には確かな診断が求められています。今回の研究は、これら薬剤の承認過程にも大きな影響を与える研究として注目されています。
特記事項
本研究は、国立研究開発法人日本医療研究開発機構(AMED)の医療研究開発革新基盤創成事業(CiCLE)「産医連携拠点による新たな認知症の創薬標的創出」の支援を受けて行われました。
【用語解説】
(注1)アルツハイマー病(Alzheimer disease)
ドイツの精神医学者Alois Alzheimer(1864~1915)により1906年に初めて報告された神経疾患で、認知症全体の約半分を占める極めて頻度の高い神経難病。記憶障害で発症し、見当識障害、実行機能の障害、理解判断力の低下などが出現し、最終的には人格の崩壊、寝たきりとなる進行性の神経変性疾患。アルツハイマー病患者の脳内では、病因物質であるアミロイドベータとタウの蓄積に伴い神経細胞が死ぬことで、症状が発現すると考えられている。脳内のアセチルコリンが減少するため、抗コリンエステラーゼ剤などの内服治療薬が症状改善には有効だが、その効果は限定的である。
(注2)見当識障害
認知症の症状のひとつで、時間や場所など、自分が置かれている状況を正確に認識できなくなること。
(注3)PET検査
Positron Emission Tomography(陽電子放出断層撮影)の略。従来のCTやMRIなどの体の構造をみる検査とは異なり、細胞の活動状況を画像でみることができ、がん、脳、心臓などの病気の診断に有効である。がんの検査では、がん細胞が正常の細胞に比べて多くのブドウ糖を取り込むという性質を利用して、放射線薬剤FDG(ブドウ糖類似PET検査薬)を体内に投与し、撮影をする検査。認知症では、病因物質(アミロイドベータとタウ)に結合する放射線薬剤を投与して撮影することにより、病因物質の蓄積を画像化できる。
参考文献
Impact of Amyloid and tau PET on Changes in Diagnosis and Patient Management.
Shimohama S, Tezuka T, Keisuke T, Bun S, Tabuchi H, Seki M, Momota Y, Suzuki N, Morimoto A, Iwabuchi Y, Kubota M, Yamamoto Y, Sano Y, Shikimoto R, Funaki K, Mimura Y, Nishimoto Y, Ueda R, Jinzaki M, Nakahara J, Mimura M, Ito D.
Neurology. 2022 Sep 29. doi: 10.1212/WNL.0000000000201389.
【本研究に先行する参考文献】
- Accuracy of the clinical diagnosis of Alzheimer disease at National Institute on Aging Alzheimer Disease Centers, 2005-2010.
Beach TG, Monsell SE, Phillips LE, Kukull W.
J Neuropathol Exp Neurol. 2012 Apr;71(4):266-73. doi: 10.1097/NEN.0b013e31824b211b. - High-Contrast In Vivo Imaging of Tau Pathologies in Alzheimer’s and Non-Alzheimer’s Disease Tauopathies.
Tagai K, Ono M, Kubota M, et al.
Neuron. 2021 Jan 6;109(1):42-58.e8. doi: 10.1016/j.neuron.2020.09.042.

