慶應発サイエンス
ケトン体(β-ヒドロキシ酪酸)による腎保護作用のメカニズム
研究の背景
ケトン体とは、β-ヒドロキシ酪酸、アセト酢酸、アセトンの総称で、絶食、低炭水化物食の摂取、激しい運動時など、体内のブドウ糖が枯渇する状態となった時にブドウ糖に代わるエネルギー源として肝臓で産生されます。ケトン体は酸なので、血中に多く含まれると血液や体液が酸性になります。このようにケトン体が増えて血液や体液が酸性になった状態をケトアシドーシスといいます(アシドーシスとは酸血症のこと)。糖尿病においては、ケトアシドーシスは主にインスリンの不足している1型糖尿病患者さんに起こります。インスリンが不足した状態では脂肪の代謝が亢進(こうしん)し、血中にケトン体が蓄積してアシドーシスを来し、ひどくなると意識障害を引き起こすため、治療しなければ死に至ります。生体の内部環境はpH7.4付近が最適な状態で、これよりも酸性でもアルカリ性でも細胞や組織の働きが低下するからです。このように、ケトン体はケトアシドーシスを引き起こす体に悪い物質と思われがちです。しかし実際は、インスリンの働きが正常で、ブドウ糖の利用が適切である限り、ある一定濃度のケトン体は極めて安全なエネルギー源となります。
近年、このケトン体のうちβ-ヒドロキシ酪酸にはエネルギー源としての作用以外に酸化反応や炎症反応を抑制する作用があることが明らかになり、心臓や脳など様々な臓器に対して保護作用があることが報告されております。しかし、ケトン体、特にβ-ヒドロキシ酪酸の腎臓に対する効果は十分に明らかにされてきませんでした。今回我々研究グループは、虚血再灌流(きょけつさいかんりゅう)による腎障害を来すマウスモデルを用いて、β-ヒドロキシ酪酸の腎臓に対する作用について検討しました。
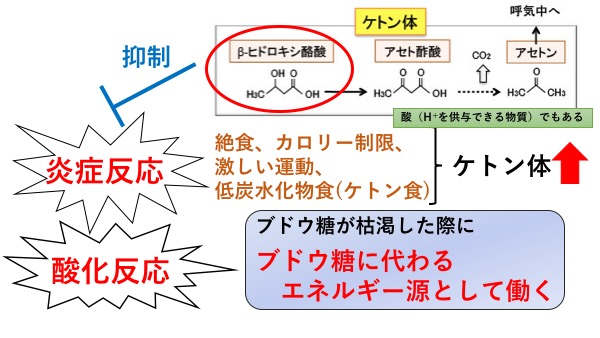
図1. ケトン体の種類とその作用
腎虚血再灌流障害とパイロトーシス
腎虚血再灌流障害は、腎臓の血流を一時的に遮断した後、その血流を再開通させることで発症します。腎臓が虚血状態に陥ると低酸素による障害が生じますが、再灌流によりさらに重篤な腎臓の臓器障害が引き起こされます。腎虚血再灌流障害は急性腎障害の原因の1つであり、出血、体液の喪失、循環不全、心血管の外科的手術、ショック並びに移植手術等で認められます。このように原因は様々ですが、その病態の発症および腎障害の進行には、プログラム化された細胞死の1つであるパイロトーシスが関わっていると考えられています。
細胞の死には、プログラム化されていない死「ネクローシス」と、プログラム化された死「アポトーシス」の2種類があります。ネクローシスでは、突然の損傷などによって、細胞が膨張破裂して細胞の内容物を放出し、その一部は周りの細胞に害を与える炎症反応を引き起こします。これに対して、アポトーシスでは、死のプログラムに従って、細胞が凝縮し、細胞骨格が壊れ、核膜が分断され、DNAは断片化し、最終的にはアポトーシス小体と呼ばれる小さな凝集体になり、マクロファージに貪食され、消化された成分は再利用されます。アポトーシスでは炎症反応は起こりません。しかし、最近になって、アポトーシスとは異なる様々にプログラム化された細胞死の存在が明らかになってきました。その1つがパイロトーシスです。パイロトーシスでは死の過程でIL-1βやIL-18などの炎症性サイトカインを放出することで、周囲の細胞に危険を知らせると同時に、炎症を惹起(じゃっき)します。そして自らは細胞死を起こすようにプログラム化された細胞自殺機構です。
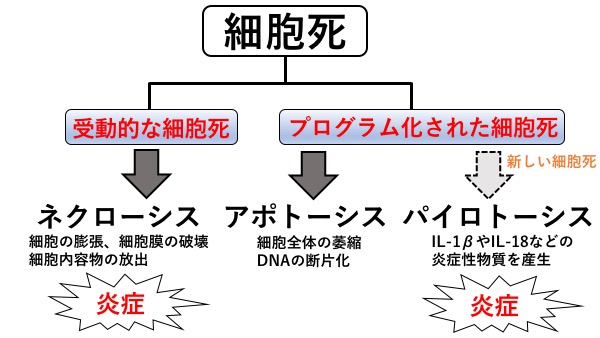
図2. 細胞死の種類
β-ヒドロキシ酪酸のパイロトーシス抑制作用を介した腎臓保護効果
我々は、腎虚血再灌流モデルマウスを用いて、β-ヒドロキシ酪酸の腎臓に対する保護効果について検討しました。まず、浸透圧ポンプを用いてβ-ヒドロキシ酪酸を腹腔内に持続投与しました。腎虚血再灌流モデルマウスの腎臓では、細胞増殖に関わるFOXO3というタンパクの発現が低下し、その下流にあるパイロトーシスに関わるCaspase-1、IL-1β、IL-18という遺伝子の発現の上昇を認め、パイロトーシスが亢進していました。しかし、β-ヒドロキシ酪酸を投与したマウスの腎臓ではFOXO3の発現が上昇し、Caspase-1、IL-1β、IL-18の発現の低下を認め、パイロトーシスが抑制されており、腎臓機能や腎組織所見の改善を認めました。β-ヒドロキシ酪酸がFOXO3の発現を上昇させたメカニズムに関してはヒストンのアセチル化が関係していました。ヒストンは、細胞の核に存在する塩基性のタンパク質で、遺伝情報をコードするDNAを包んでいます。このヒストンへのアセチル基の付加反応のことを「ヒストンのアセチル化」と呼びます。一般に、ヒストンがアセチル化されると、遺伝子の発現が促進する方向に働きます。すなわちDNAの転写が活性化されます。逆に発現を抑制する場合は、ヒストン脱アセチル化酵素によってアセチル基が除去され、その結果、ヒストンとDNAの結合が強固になり、遺伝子の発現は抑制されます。腎虚血再灌流モデルマウスの腎臓ではこのヒストンのアセチル化の低下を認めましたが、 β-ヒドロキシ酪酸を投与したマウスの腎臓では、ヒストンのアセチル化の亢進を認めました。腎臓の尿細管細胞を用いた細胞実験の検討により、β-ヒドロキシ酪酸には上記のヒストン脱アセチル化酵素を抑制する作用があることが分かりました。つまりヒストン脱アセチル化酵素を抑制することでアセチル基がヒストンに付加されている状態にし、その結果ヒストンのアセチル化の亢進およびFOXO3の発現の上昇を認めました。以上より、β-ヒドロキシ酪酸はヒストン脱アセチル化酵素を抑制する作用を有し、ヒストンのアセチル化によるFOXO3の発現の上昇を引き起こし、パイロトーシス抑制作用を発揮し腎臓に対して保護的に作用する可能性を見出しました。
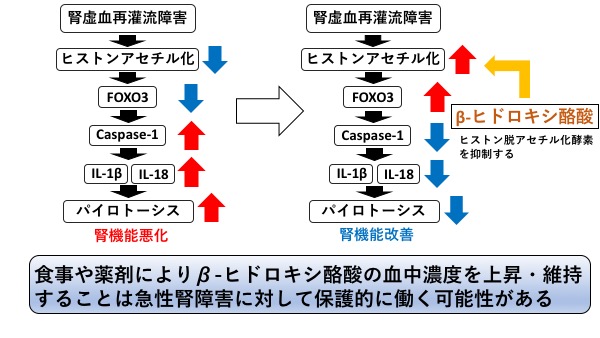
図3. β-ヒドロキシ酪酸によるパイロトーシス抑制作用を介した腎臓保護作用
今後の展望
今回、我々研究グループは、ケトン体の1つであるβ-ヒドロキシ酪酸をポンプを用いて直接投与することによって腎虚血再灌流障害が改善することを見出しました。低炭水化物食などの食事や薬剤などにより、β-ヒドロキシ酪酸の血中濃度を上昇・維持させることができれば、急性腎障害に対する新しい治療戦略になりうる可能性があります。
参考文献
β-hydroxybutyrate attenuates renal ischemia-reperfusion injury through its anti-pyroptotic effects
Tajima T, Yoshifuji A, Matsui A, Itoh T, Uchiyama K, Kanda T, Tokuyama H, Wakino S, Itoh H.
Kidney International. 2019 May;95(5):1120-1137.

左より:田島敬也(腎臓内分泌代謝内科助教)、脇野修(同准教授)

