慶應発サイエンス
化学治療抵抗性乳がん細胞の代謝特性
はじめに:乳がんの抗がん剤耐性について
日本では、乳がんは年間約10万人が罹患し、女性ではほぼ9人に1人が生涯のうちにかかるといわれ、欧米の罹患率に迫る勢いで増加しています。乳がんはその特徴によっていくつかに分類でき、発現する3種類の受容体の違いによって4つの代表的なタイプに分類され、それぞれで治療方針が決められています。中でも「トリプルネガティブ」乳がん(注1)は乳がん全体の15%を占め、分子標的薬が存在しないこと、しばしば再発し薬剤抵抗性を獲得してしまう点が特徴であり再発後の生存期間が短いことが知られています。
一般的にがん細胞の特徴として、急速な増殖、高い細胞運動能、ストレス耐性などが挙げられますが、これらを標的とした抗がん剤を使い続けることでしばしば耐性を獲得することが大きな問題です。耐性を獲得するメカニズムは多様で、薬剤排出系の亢進や遺伝子変異による増殖シグナルの暴走などが知られています。このような耐性を克服する方策を確立することは社会的にも重要な要請です。今回私たちは、抗がん剤に対する感受性の違いが取り込んだブドウ糖の使われ方の違いに依存するという全く新しい機序を発見しました。
化学治療抵抗性乳がんの「代謝嗜好性」
まず私たちはトリプルネガティブ乳がんの標準治療で用いられる抗がん剤パクリタキセル(注2)に対する耐性をもつ乳がん細胞を樹立し、感受性に差異のある細胞間で代謝特性に違いがあるかを比較検討しました。その結果、耐性をもつ乳がん細胞ではホスホフルクトキナーゼ/フルクトースビスホスファターゼ3(PFKFB3)、ピルビン酸キナーゼ(PKM2)という細胞のエネルギー産生に重要な解糖系(注3)の律速段階を制御する酵素、およびホスホセリン脱水素酵素(PHGDH)という非必須アミノ酸であるセリンの合成経路にあたる酵素のメチル化修飾(注4)レベルが高いことを発見しました。さらに代謝解析の結果からも耐性細胞では取り込まれたブドウ糖が解糖系から分岐するセリン合成経路へと代謝経路が切り替わるという代謝的特性が浮かび上がりました(図1)。
次になぜセリン合成経路が耐性獲得に重要なのか、その意義について検討しました。セリン生合成経路は核酸合成や脂肪酸合成、硫黄代謝と細胞増殖に重要な代謝経路へのハブ回路になっています。本研究ではパクリタキセル耐性乳がん細胞において脂肪酸の合成能力が極めて高いことが分かりました。脂肪酸は活発に増殖する細胞の膜成分の材料にもなりますが、脂肪酸合成の亢進により脂肪酸が一部の酵素との間で共有結合するS-パルミトイル化修飾(注5)という化学修飾を通じて、パクリタキセル耐性乳がん細胞ではセリン生合成経路の活性が高く保持されることが分かりました。
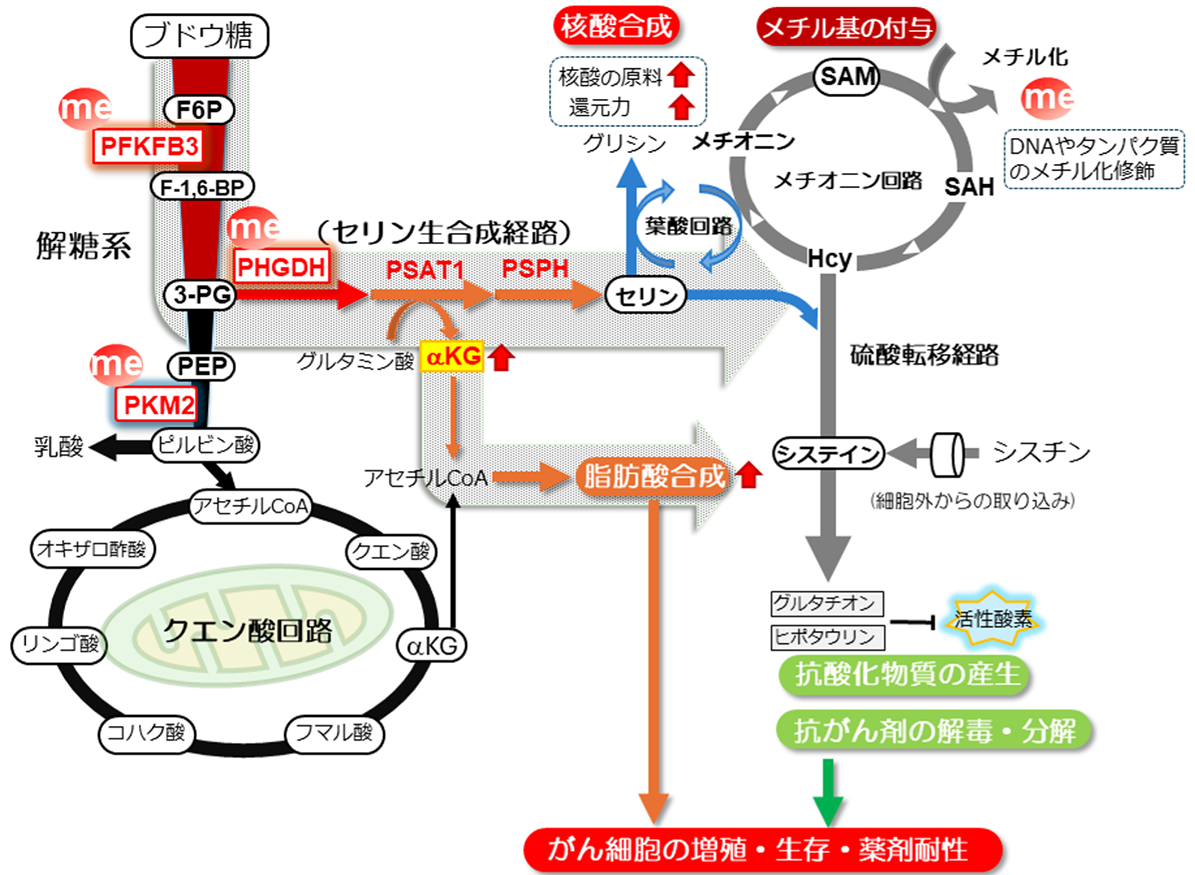
図1.パクリタキセル抵抗性乳がん細胞の代謝特性
メタボローム解析の結果から、パクリタキセル抵抗性の乳がん細胞では、取り込まれたブドウ糖はエネルギー産生に重要な経路である解糖系から途中で分岐するセリン生合成経路を経て代謝され、結果として脂肪酸合成経路が活性化されることが分かった。
乳がん組織中の解糖系酵素のメチル化修飾レベルは化学治療の奏功と相関する
このように、化学治療抵抗性を示す乳がん細胞では1)解糖系の活性化、2)セリン合成経路の活性化、3)脂肪酸合成の活発化、3つの代謝経路の活性化が示されました。このような特徴が培養細胞レベルだけでなく、実際の患者さんについても当てはまるかを調べるために、以下の検討を行いました。
実際のトリプルネガティブ乳がんに罹患した患者さんの術前組織診断(注6)で使用されたサンプルを用いて、組織切片上の代謝物の組織分布を検出するとともに、上記の解糖系酵素群のメチル化の度合いについても免疫染色法にて判定しました。その結果、がん細胞集塊部において脂肪酸の合成および分解に関与する代謝物の集積が見られたのと同時に、上記の3つの酵素(PFKFB3、PKM2、およびPHGDH)のメチル化型ががん細胞の核内に認められました(図2)。また、予後の悪い患者さんではメチル化型酵素の核局在が有意に高頻度で認められました。言い換えれば、酵素のメチル化の度合いはパクリタキセルに対する薬剤抵抗性の有無の指標となることを意味します。
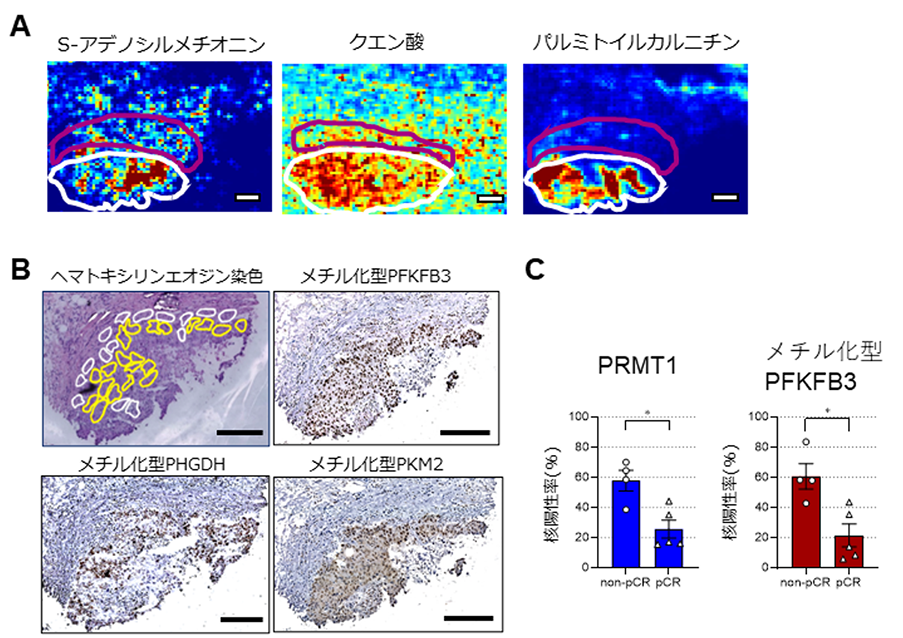
図2.予後不良のトリプルネガティブ乳がん細胞では解糖系酵素の高メチル化が認められる
- (A)イメージングメタボロミクス解析の結果。白線はがん集塊部、マゼンタはがん間質(注7)部を指す。セリン生合成系を経て産生されたと思われるS-アデノシルメチオニン、および脂肪酸合成や分解途中で産生されるクエン酸、パルミトイルカルニチンなどの蓄積ががん部において認められた。
- (B)(A)と同一の凍結切片を用いた乳がん患者の針生検の免疫染色像。黄色で囲われた部分はがん細胞集塊部、白はがん間質部分を示す。がん集塊部において解糖系酵素PFKFB3、PHGDH、PKM2のメチル化型が核に局在する。
- (C)トリプルネガティブ乳がん患者のうち病理学的完全奏効に達した群(pCR)と達しなかった群(non-pCR)に分けてがん細胞におけるメチル基転移酵素PRMT1とメチル化型PFKFB3の核陽性細胞数を測定した。non-pCR群において有意にメチル化レベルが高かった。
※スケールバーは(A)200μm、(B)250μmを示す。
脂肪酸代謝の阻害は抗がん剤耐性を喪失させる
さらに私たちは抗がん剤耐性乳がんの代謝特性に介入することで、その抵抗性を操作できるかを実験的に検証しました。耐性細胞での高い脂肪酸合成能に着目し、脂肪酸の合成阻害剤や代謝酵素のメチル化修飾に対する阻害剤でがん細胞を処理したところ、驚くべきことにパクリタキセルに対する抵抗性が解除されました。逆に脂肪酸合成を活性化させる処置を施すと感受性をもっていた細胞が抵抗性を示すようになりました。また、タンパク質のS-パルミトイル化修飾に対する阻害剤で処理した場合においても抵抗性が解除されることが分かりました。同様の結果は、パクリタキセル耐性細胞を移植したマウス実験においても確認できました。これらの実験結果より、耐性細胞の代謝を人為的に操作することでパクリタキセルに対する耐性を喪失させ、感受性の回復が見込める可能性を示しました。
今後の展望
今回の研究から、抗がん剤抵抗性をもつ乳がん細胞では、代謝経路の切り替えが起こり、脂肪酸合成を活発に行うことが分かりました。また、代謝特性への介入により、化学治療抵抗性は可逆的に操作可能であることを実験的に示した点、術前組織診断の段階で代謝酵素のメチル化の状態から化学治療の効果が推定できる可能性など、今後の研究にとって示唆に富む重要な知見が得られました。より詳細なメカニズムが明らかになれば、単剤では効果の弱い従来の抗がん剤治療の効果を高めることが期待されると考えます。
【用語解説】
(注1)トリプルネガティブ乳がん
ER(estrogen receptor:エストロゲン受容体)、PgR(progesterone receptor:プロゲステロン受容体)、HER2(human epidermal growth factor receptor 2:上皮成長因子受容体2)これら3つの蛋白発現が陰性である乳がんのサブタイプ。内分泌療法が奏効せず、有効的な治療標的が存在しない。現在は抗がん剤および免疫チェックポイント阻害剤が有効であるが、ほかのサブタイプと比較して転移再発率が高く予後が不良である。
(注2)パクリタキセル
がん化学療法において用いられる有糸分裂阻害剤の一つである。細胞骨格タンパク質のチューブリンに対して脱重合阻害活性を有し、細胞分裂を阻害させる効果をもつ。
(注3)解糖系
ブドウ糖をピルビン酸や乳酸などの有機酸に分解する代謝経路。反応に酸素を必要としないため、嫌気的条件下においてもATPを産生できる代謝経路である。
(注4)メチル化修飾
DNAやRNA、タンパク質、脂質など様々な基質にメチル基(-CH3)が置換もしくは結合することを指す。メチル化反応はメチオニン代謝の中間代謝物質S-アデノシルメチオニン(SAM)がメチル基転移酵素によってメチル基が供与されることによって起こる。タンパク質の場合は主にアルギニン、リジン残基がメチル化修飾を受け、その機能調節に極めて重要な翻訳後修飾である。
(注5)S-パルミトイル化修飾
パルミトイル化は翻訳後修飾の一種で、飽和脂肪酸由来のパルミトイルCoAを基質のタンパク質に付加する反応である。特にシステイン残基チオエステル結合によって付加する可逆的な反応のことをS-パルミトイル化と呼ぶ。
(注6)術前組織診断
腫瘍の位置を確認しながら、針で穿刺を行うことで乳がん組織を取り出して病変組織を病理学的に観察・診断すること。
(注7)がん間質
がん細胞は繊維芽細胞や血管細胞や免疫細胞など周囲の環境から増殖に必要な因子や、栄養、足場の提供を受けて増殖や進展を引き起こすことが知られているが、このようにがん細胞を取り巻く、異種かつ多様な細胞およびコラーゲンなどのタンパク質成分の総称をがん間質と呼ぶ。
参考文献
PRMT1 sustains de novo fatty acid synthesis by methylating PHGDH to drive chemoresistance in triple-negative breast cancer.
Yamamoto T, Hayashida T, Masugi Y, Oshikawa K, Hayakawa N, Itoh M, Nishime C, Suzuki M, Nagayama A, Kawai Y, Hishiki T, Matsuura T, Naito Y, Kubo A, Yamamoto A, Yoshioka Y, Kurahori T, Nagasaka M, Takizawa M, Takano N, Kawakami K, Sakamoto M, Wakui M, Yamamoto T, Kitagawa Y, Kabe Y, Horisawa K, Suzuki A, Matsumoto M, Suematsu M.
Cancer Research. 2024 Apr 1;84(7):1065-1083. doi: 10.1158/0008-5472.CAN-23-2266.

