慶應発サイエンス
ヒトES・iPS細胞からつくった心筋細胞で心臓病を治すには?
ES細胞とiPS細胞 : あらゆる細胞を生み出す”万能細胞”
ES細胞は、受精卵から取り出した細胞を培養することによって作られる幹細胞の一つです。無限に増える特殊な能力をもち、なおかつ心臓の細胞や神経の細胞、血液の細胞などのあらゆる細胞を生み出すことができるため”万能細胞”ともよばれています(図1)。しかし、生命の源となるはずの受精卵を壊さなければならないという倫理上の問題や、ES細胞からつくった細胞を移植する場合、移植した細胞が免疫系の細胞によって攻撃されてしまう免疫拒絶反応などの問題がありました。そこで誕生したのが、2006年に京都大学の山中教授らによって作製されたiPS細胞です。iPS細胞は、皮膚や血液など生殖細胞ではなく体細胞に数種類の遺伝子を入れることによってES細胞と同様の性質を持たせることが可能となった新しい”万能細胞”です(図1)。iPS細胞の誕生は、すでに分化した体細胞をさまざまな細胞に変わりうる未分化な状態に戻すことができたことを意味しており、”細胞版タイムマシーン”とも呼ばれています。iPS細胞はES細胞のように受精卵を壊す必要がなく、患者さん自身の体細胞を利用することにより万能細胞を作ることができるため、前にあげた倫理的な問題や免疫拒絶反応の問題を一挙に解決できるという利点があり、今後ヒトへの臨床応用に有用な細胞として大きく期待されています。
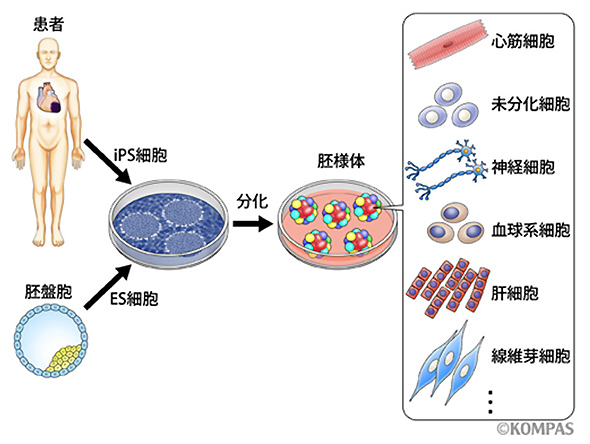
図1. ヒトES細胞とiPS細胞
ヒトES・iPS細胞は心筋細胞を含めたあらゆる細胞に分化することができるため、さまざまな分野における再生医療への応用が期待されている。
ES・iPS細胞を用いた心臓再生医療の問題点
心筋梗塞、拡張型心筋症などが重症化すると数億個もの心筋細胞が失われてしまいます。しかし、ヒトを含む哺乳類は失われた心筋細胞を元に戻す自己再生能力を持っていないため、心臓の機能は低下する一方です。そこで、ES細胞やiPS細胞からつくった心筋細胞を移植することによって補充し心臓を再生させるという”心臓再生医療”が期待されています。
しかし、ES細胞やiPS細胞からつくった心筋細胞を単に移植すればよいわけではありません。なぜなら、ES 細胞やiPS 細胞のような万能細胞には、あらゆる細胞を生み出す能力がある反面、分化した細胞集団の中でES細胞やiPS細胞がそのまま(未分化な細胞)で残ってしてしまうという性質があるからです。仮にこうした未分化な細胞が体の中に移植されると、癌のような腫瘍を形成する危険性があるのです(図2)。ES細胞やiPS細胞にはこのような危険性があり、再生医療の実現化を妨げるものになっていました。そのために、いかに腫瘍の原因となる未分化な細胞を取り除くか、あるいは目的とする心筋細胞だけを選択的に回収するかに関する研究の進展が期待されてきました。
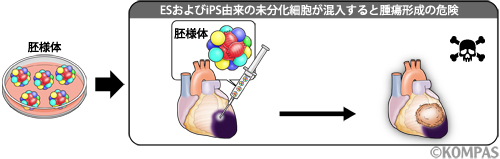
図2. ヒトES・iPS細胞を用いた心臓再生医療の問題点
ヒトES・iPS細胞から分化させた細胞集団の中には、未分化細胞が残存してしまうという問題があり、仮に移植細胞の中に未分化細胞が混入してしまうと腫瘍を形成する危険性がある。
ES・iPS細胞由来の心筋細胞のみを選別する方法
心筋細胞だけを選択的に回収する取り組みとして、遺伝子操作を行うことによって心筋細胞だけに蛍光タンパク質を発現させ、その蛍光を利用して分離するなどの研究が行われてきましたが、ヒトへの細胞移植に際しては安全性などの面で問題がありました。この問題を克服するため、わたしたちのグループは2010年にFACSという機械を用いて、蛍光色素を用いて心筋細胞を識別し1細胞ずつ心筋細胞を回収する方法を確立し報告しました(文献1)。しかし、重症心不全の患者さんの失われた心臓の機能を補うためには、数億個の心筋細胞を準備しなければならず、1細胞ずつ心筋細胞を選別する方法では莫大な時間がかかってしまいます。そこでわたしたちは、より簡便で効率よく心筋細胞だけを選択的に回収する方法を探索しました。
細胞を培養する際には、培養液という細胞の生存にとって必要な栄養素を含む液体中で行いますが、その必要成分は細胞の種類によって異なります。そこで、培養液を『心筋細胞のみが生きることができ、未分化な細胞や心筋以外の細胞が生きることのできない環境』にすること、すなわち”培養液を変える”という簡便な方法によって、効率よく未分化な細胞を除き、心筋細胞のみを選択的に回収できれば、理想的な方法になるのではないかと考えました。
ES・iPS細胞と心筋細胞の代謝の違い
上述の目標を達成するために、まず、回収したい細胞である心筋細胞と除去したい細胞である未分化な細胞(ES細胞)の代謝を比較しました。その結果、ES細胞ではグルコース(ブドウ糖)を活発に利用することで、エネルギーを得ているだけでなく、増殖する際に必要となるアミノ酸や核酸を作り出していることがわかりました。一方で、心筋細胞はES細胞ほどグルコースの代謝は活発ではなく、代わりに細胞内のミトコンドリアにおいて酸化的リン酸化という、極めて効率よいエネルギー変換システムでエネルギーを得ていることがわかりました。さらに、ES細胞だけではなく、ES細胞と同じように増殖する能力をもった他の細胞もES細胞に似た代謝パターンをとっていることを明らかにしました(図3)。
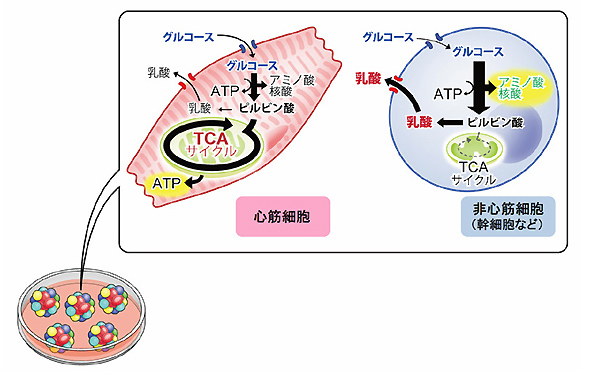
図3. 心筋細胞とES・iPS細胞を含む増殖細胞の代謝の違い
ES・iPS細胞を含む増殖細胞ではグルコースを活発に利用することでエネルギーを得ている。一方で、心筋細胞はミトコンドリアにおける酸化的リン酸化という、極めて効率よいシステムによってエネルギーを得ている。
(詳細はプレスリリースをご参照ください。)
そこで、ES細胞を含む増殖細胞と心筋細胞の代謝の違いに着目し、『心筋細胞のみが生きることができ、未分化な細胞や心筋以外の細胞が生きることのできない環境』を作り出すために、通常は培養液に必要不可欠とされるグルコースをとりのぞき、心筋細胞にとってエネルギー源となる乳酸を加えることにより、心筋細胞のみを選択的に培養できるのではないかと考え、”無グルコース乳酸添加培養液”を作りました。実際に、ヒトES細胞やiPS細胞から生み出されるさまざまな細胞集団を”無グルコース乳酸添加培養液”中で培養すると、心筋細胞のみが選択的に生き残ることが確認されました(文献2)。さらに、選択的に回収されたヒトES細胞由来の心筋細胞には腫瘍形成の原因となる未分化な細胞は残っておらず、またこの細胞を移植しても腫瘍を形成しなかったことから、安全な心筋細胞であることが確認されました。このように、これまで行っていた遺伝子操作やFACSという蛍光を利用した選別を用いることなく、「培養液を交換する」という極めて単純な作業によって、腫瘍化のリスクの極めて低い精製心筋細胞を安価かつ大量に得ることが可能となったのです(図4)。
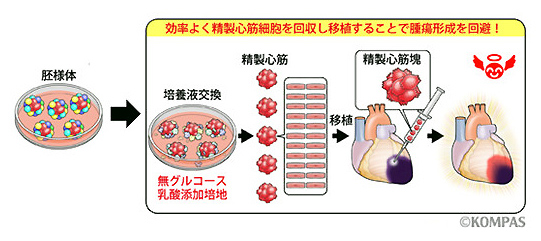
図4. ヒトES・iPS細胞を用いた今後の心臓再生医療
ヒトES・iPS細胞から分化させた細胞集団の中から、培養液を交換することによって効率よく未分化細胞を除去し、心筋細胞のみを精製することにより、移植の際の腫瘍形成の危険性を回避することができる。
おわりに
ヒトES細胞あるいはiPS細胞を用いた心臓再生医療を実現化するためには、いかに効率よくかつ安価に腫瘍の原因となる未分化な細胞は除去し、その一方で大量の精製された心筋細胞を回収できるかが重要となります。わたしたちは、遺伝子操作やFACSなど複雑な技術を用いることなく、細胞によって異なる代謝の特性を利用し、培養液の組成を変えるという安価かつ簡便な方法により、癌のような腫瘍を形成する危険性が極めて低い安全な心筋細胞を大量に得ることに成功しました。この方法の確立により、心臓再生医療における最も大きなハードルであった移植心筋細胞における「量」と「質」の問題を克服することができると考えています。今後は、ヒトESあるいはiPS細胞由来の精製された心筋細胞を用いた細胞移植療法の安全性および有効性を十分に評価し、臨床的にも有用な治療法として患者さんへ還元できることを目指して研究を進めていきたいと考えています。
参考文献
文献1
Nongenetic method for purifying stem cell-derived cardiomyocytes.
Hattori F, Chen H, Yamashita H, Tohyama S, Satoh YS, Yuasa S, Li W, Yamakawa H, Tanaka T, Onitsuka T, Shimoji K, Ohno Y, Egashira T, Kaneda R, Murata M, Hidaka K, Morisaki T, Sasaki E, Suzuki T, Sano M, Makino S, Oikawa S, Fukuda K.
Nat Methods. 2010 Jan;7(1):61-6. doi: 10.1038/nmeth.1403. Epub 2009 Nov 29.
http://www.nature.com/nmeth/journal/v7/n1/abs/nmeth.1403.html![]()
文献2
Distinct Metabolic Flow Enable Large-Scale Purification of Mouse and Human Pluripotent Stem Cell-Derived Cardiomyocytes.
Tohyama S, Hattori F, Sano M, Hishiki T, Nagahata Y, Matsuura T, Hashimoto H, Suzuki T, Yamashita H, Satoh Y, Egashira T, Seki T, Muraoka N, Yamakawa H, Ohgino Y, Tanaka T, Yoichi M, Yuasa S, Murata M, Suematsu M, Fukuda K.
Cell Stem Cell 2013 Jan 3;12(1):127-37. doi: 10.1016/j.stem.2012.09.013. Epub 2012 Nov 15.
http://www.sciencedirect.com/science/article/pii/S1934590912005796![]()

遠山周吾
(循環器内科助教)

