はじめに
パーキンソン病の治療には薬物療法のほかに、機械を用いることで症状の日内変動(ウェアリングオフ現象)やジスキネジアを緩和することができるデバイス補助療法(Device aided therapy: DAT)があります。パーキンソン病に対するDATとしては脳深部刺激療法(Deep brain stimulation: DBS)、レボドパ・カルビドパ配合経腸用液療法(Levodopa-carbidopa continuous infusion gel therapy: LCIG、デュオドーパ®)、ホスレボドパ・ホスカルビドパ水和物持続皮下注療法(Continuous subcutaneous infusion: CSCI、ヴィアレブ®)、アポモルヒネ皮下注射(アポカイン®)が日本では承認されており、慶應義塾大学病院ではこれらの治療を全て受けることができます。デバイス補助療法の多くは近年開発されたものですが、日々進歩を遂げています。今回、デバイス補助療法の進歩について紹介いたします。
脳深部刺激療法(DBS)の進歩
パーキンソン病に対するDBSは日本で2000年に保険適用となった20年以上の歴史のある治療法です。当初は術後の精神症状や認知症状の出現が問題視されていましたが、運動や精神をつかさどる神経核の場所がはっきりしたことや長期経過の報告が登場してくる中で、安全性・効果ともにすぐれた治療法として認識されるようになりました。
近年、脳を刺激する電極に指向性をもたせる(刺激する向きや形を自由に調整できる)ことが可能となるDirectional lead(図1)や電極を留置した場所の微小な脳活動(Local Field Potential: LFP)を記録し、その波長に合わせて刺激の調整を行う(adaptive DBS: aDBS)ことが可能になりました。DBSではパーキンソン病の運動症状を改善させる部位だけではなく、周辺にも刺激が及んでしまうことで刺激による副作用(錐体路障害(手足を動かしづらくなる)や精神症状など)が出現することがあります。Directional leadを使用することで、運動症状を改善させる部位に限局的に刺激を与えることが可能となり、副作用の軽減・回避を図ることが可能となります。また、LFPで記録されるβ(ベータ)帯域の波形とパーキンソン病の運動症状である運動緩慢(動作が遅く小さくなる)、筋強剛(筋肉がこわばる)が強く関連することが報告されており、β帯域を電極で検知し、それに合わせて刺激を調整することで、運動症状のより良い改善が期待されています。
ほかにも、術後に最適な刺激部位、刺激の強さを決定するためにリードの全ての電極で刺激を行い、症状の変化を確認するMonopolar review(モノポーラーレビュー)というものが通常行われますが、検査に時間がかかることが問題となっていました。近年、画像から最良の刺激部位を推察する方法(Guide XT(図2))が登場したことで、従来1時間以上かかっていた検査が数十分で可能となり、従来のMonopolar reviewでの刺激の改善効果と同等であるという報告がなされています。
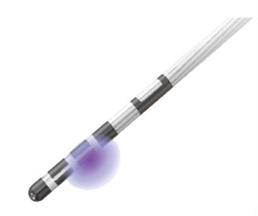
図1.Directional leadの刺激の様子
(Boston Scientific社より許可を得て掲載)
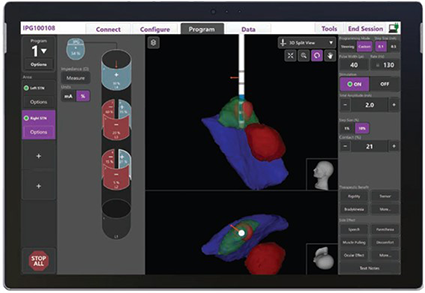
図2.バーサイスDBSシステム(Image Guided Programming with Vercise™ DBS Systems)による刺激部位の可視化
(Boston Scientific社より許可を得て掲載)
レボドパ・カルビドパ配合経腸用液療法(LCIG)の進歩
LCIGはゲル状になったレボドパ製剤(レボドパ・カルビドパ水和物配合剤)をおなか(胃部)に作成した穴から挿入したチューブを通して、空腸に持続的に投与する治療です。日本では2016年に承認されました。レボドパの吸収部位に直接・持続的に投与することで、ウェアリングオフ現象やジスキネジアの改善が期待できる治療法ですが、従来使用されていたチューブでは腸管内でチューブが絡まったり折れてしまったり、体の外でチューブに亀裂や接続部のゆるみが生じて液漏れが起きてしまうなどのチューブトラブルが多いことが問題となっていました。これらのチューブトラブルの頻度を減らすべく、2020年に新しい形状のチューブが登場しました。従来型のチューブは先端が豚のしっぽのように360度くるっとまわっており、造影も非対応でしたが、新チューブではチューブ先端の曲がりが約270度になることで、結び目ができにくくなり、造影対応になることで上部消化管内視鏡(胃カメラ)を使用せずにチューブ交換を行うことができるようになりました(図3)。その後2度の改良が重ねられ、最新のチューブはよりチューブトラブルが少ないものになっています。

図3.レボドパ・カルビドパ配合経腸用液療法チューブの進歩
(アッヴィ合同会社より許可を得て掲載)
ホスレボドパ・ホスカルビドパ水和物持続皮下注療法(CSCI)の登場
CSCIはレボドパ・カルビドパのプロドラッグ(体内で代謝されてから作用を及ぼすタイプの薬)であるホスレボドパ・ホスカルビドパ水和物を体外のポンプで持続的に皮下注射する治療法です(図4)。2022年12月に承認を受け、2023年7月より使用可能となりました。レボドパ製剤をポンプの力で持続的に投与するという点ではLCIGと共通していますが、CSCIは24時間投与であること(LCIGは日本では16時間投与)、皮下注射なので手術が不要であることが特徴です。持続的に投与することでウェアリングオフ現象やジスキネジアが軽快することが期待され、海外の研究ではウェアリングオフ現象や生活に支障を来すジスキネジアが1日3時間程度減少することが示されています。24時間の持続投与が可能であるため、チューブの洗浄処置が不要なだけではなく、内服薬などではカバーしづらい夜間や起床時の症状の改善に寄与できる可能性があります。一方、皮下注射であるため皮膚の発赤、炎症などには注意が必要です。
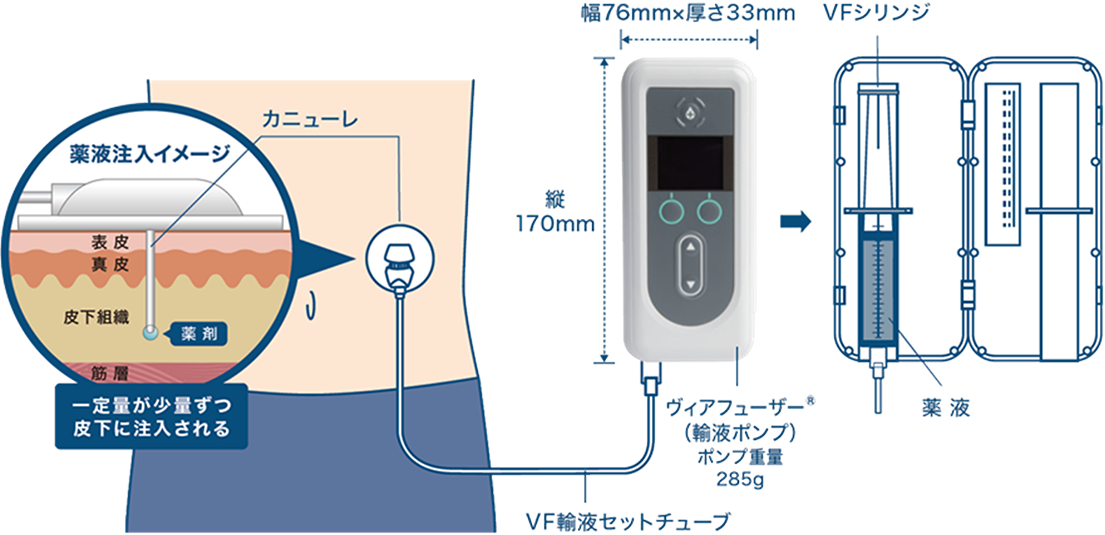
図4.ホスレボドパ・ホスカルビドパ水和物持続皮下注療法の投与イメージ
(アッヴィ合同会社より許可を得て掲載)
ご紹介したデバイス補助療法の進歩により、より幅広い患者さんに、より安全にデバイス補助療法をご提案、ご提供できるようになってきています。デバイス補助療法は適切な患者さんに適切なタイミングで行うことで、内服薬ではコントロールが困難なウェアリングオフ現象、ジスキネジアといった運動合併症やドパミン反応性の症状を改善しうる治療法です。言い方を変えれば、適切でないご病状の患者さんに適切でない時期に行っても期待するほどの効果は得られません。
当院パーキンソン病センター![]() では、パーキンソン病を専門とする医師が慎重に適応を判断しております。詳しくは、パーキンソン病外来担当医表
では、パーキンソン病を専門とする医師が慎重に適応を判断しております。詳しくは、パーキンソン病外来担当医表![]() をご参照ください。
をご参照ください。

パーキンソン病センタースタッフ
文責:パーキンソン病センター![]()
執筆:大草翔平、関守信
最終更新日:2024年4月1日
記事作成日:2024年4月1日