慶應発サイエンス
腎臓・免疫・代謝連関 ― 尿細管DNA損傷に起因する新規メカニズムの解明
研究の背景
近年、日本では高齢化や生活習慣病の増加により、慢性腎臓病(CKD)の患者さんが増えています。CKDが進行すると、腎臓の働きが低下し、透析など腎臓の代わりとなる治療が必要になることがあります。さらに重要なのは、CKDは腎臓だけでなく、心臓や血管、免疫、神経、筋肉や骨などの全身の老化を早め、様々な合併症のリスクを高めるという点です。このため、CKDの影響は腎臓にとどまらず、全身の健康維持にも深く関わっていることが分かってきました。では、腎臓の障害と全身老化の関係はどのように説明できるのでしょうか。近年注目されているのが、腎臓の細胞に起こるDNAの損傷(注1)です。
DNAは細胞の設計図のようなもので、傷がつくと細胞の老化や炎症を引き起こし、周囲の臓器や遠く離れた組織にまで影響を与える可能性があります。
特に、近位尿細管の細胞は尿から水分や栄養分を再吸収し体のバランスを保つ重要な役割を担っており、腎臓の中でも最も代謝が活発な細胞です。そのため、酸化ストレスがたまりやすく、DNA損傷のリスクに常にさらされています。さらに、糖尿病や肥満など腎臓に負担をかける生活習慣病は、近位尿細管のDNA損傷を蓄積させる可能性があります。そのため、近位尿細管のDNA損傷が腎臓の病気や全身の老化にどのように関わるかを理解することは、CKDの患者さんに起こり得る合併症を防ぎ、健康を維持するうえで欠かせない研究テーマです。
研究の概要
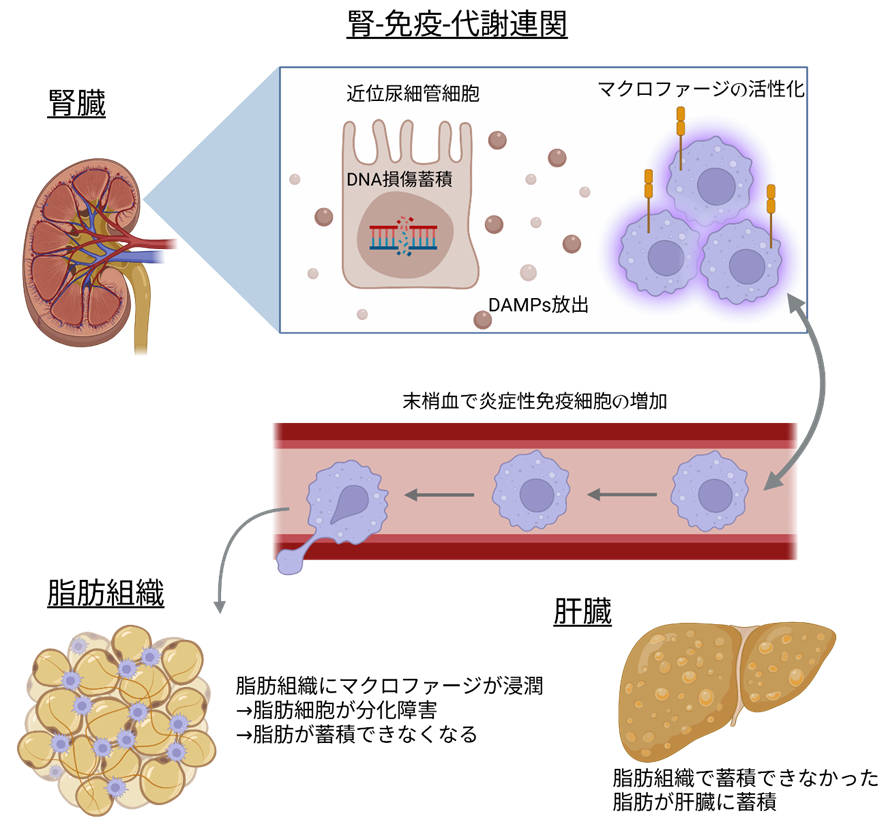
私たちの研究では、近位尿細管のDNA損傷が腎臓だけでなく、全身臓器の老化にどのような影響を与えるかを調べました。動物モデルを用いた実験では、腎臓近位尿細管のDNAが傷つくと、腎臓の中では炎症が起こるものの、腎機能自体は大きく低下しません。しかし、体全体では体重減少や皮下・内臓脂肪の減少がみられる一方で、肝臓には脂肪が蓄積し、血糖の調節も乱れることが分かりました。このような脂肪組織の減少と肝臓への脂肪蓄積が同時に起こる状態は、「リポジストロフィー」(注2)と呼ばれ、脂肪代謝のバランスが崩れていることを示しています。この状態は、CKD患者で認められるやせ型の代謝変容と類似していると考えられます。これらの変化は予後不良と強く関連していることが知られており、その詳細なメカニズムの解明は非常に重要です。
私たちは、このメカニズムの中心には「マクロファージ」と呼ばれる免疫細胞があることを突き止めました。傷ついた近位尿細管の細胞からは、周囲の細胞に警告を送る「危険信号(DAMPs)」(注3)が放出されます。腎臓では、CD11c陽性という炎症に関わる特徴をもつマクロファージが活性化されます。興味深いことに、これらのマクロファージは血液を介して脂肪組織に移動し、同じような性質をもつマクロファージが脂肪組織でも増加していました。その結果、脂肪細胞の分化や代謝がうまくいかなくなり、全身の代謝バランスが崩れることが分かりました。さらに、マクロファージを取り除くと血糖の調節異常が改善されることから、免疫細胞の活性化が代謝異常の中心的な役割を果たしていることが明らかになりました(図1)。
今後の展望
この研究は、近位尿細管のDNA損傷が局所の炎症や免疫応答を介して全身の代謝や老化に影響を与える「腎-免疫-代謝連関」の存在を示すものです。将来的には、この連関を標的にすることで、CKD患者に起こる合併症の予防や、生活習慣病による全身老化の進行を抑える新しい治療法の開発につながることが期待されます。CKDを単なる腎機能低下の病気としてではなく、老化の一側面として包括的に理解するための重要な手がかりとなると考えられます。
【用語解説】
(注1)DNA損傷
紫外線、放射線、化学物質などの外的要因や、細胞内の代謝活動によってDNAが切断されるなど傷がつく現象である。日常的に頻繁に起こるが、細胞にはこれを修復する仕組みが備わっている。しかし、損傷が大きすぎると細胞死や老化、がん化の原因となることがある。
(注2)リポジストロフィー
脂肪組織の量や機能が低下する一方で、肝臓やほかの臓器に脂肪が蓄積する代謝異常の状態を指す。この状態では、脂肪細胞の分化や代謝バランスが崩れ、全身のエネルギー代謝に影響を及ぼす。CKDや一部の遺伝性疾患で認められることがある。
(注3)DAMPs(Danger-Associated Molecular Patterns)
細胞が傷ついたときやストレスを受けたときに放出される分子で、周囲の免疫細胞に危険信号を伝える役割をもつ。DAMPsはマクロファージなどの免疫細胞を活性化し、炎症反応の誘導に関与する。
参考文献
DNA damage in proximal tubules triggers systemic metabolic dysfunction through epigenetically altered macrophages.
Nishimura ES, Hishikawa A, Nakamichi R, Akashio R, Chikuma S, Hashiguchi A, Yoshimoto N, Hama EY, Maruki T, Itoh W, Yamaguchi S, Yoshino J, Itoh H, Hayashi K.
Nat Commun. 2025 Apr 28;16(1):3958. doi: 10.1038/s41467-025-59297-x.


