慶應発サイエンス
筋萎縮性側索硬化症における新規治療ターゲット、核膜・核膜孔障害の発見
筋萎縮性側索硬化症(Amyotrophic Lateral Sclerosis: ALS)とは
筋萎縮性側索硬化症は、運動ニューロンが徐々に障害を受ける神経難病です。運動ニューロンが障害を受けることで、ALSの患者さんは立つ、歩く等の運動動作に加えて、話す、食べる等の基本的な日常動作が困難となり、発症数年のうちに生命に必須の呼吸運動も障害されてしまいます。全世界で毎年14万人が新たにALSと診断され、日本には約9,000人の患者さんがいます。日本では、2剤(リルゾールとエダラボン)が治療薬として承認されており、今後メコバラミン筋注の承認が期待されますが、更なる治療薬の開発が望まれています。
ゲノム編集マウス・iPS細胞・病理検体から病態解明の糸口を見出す
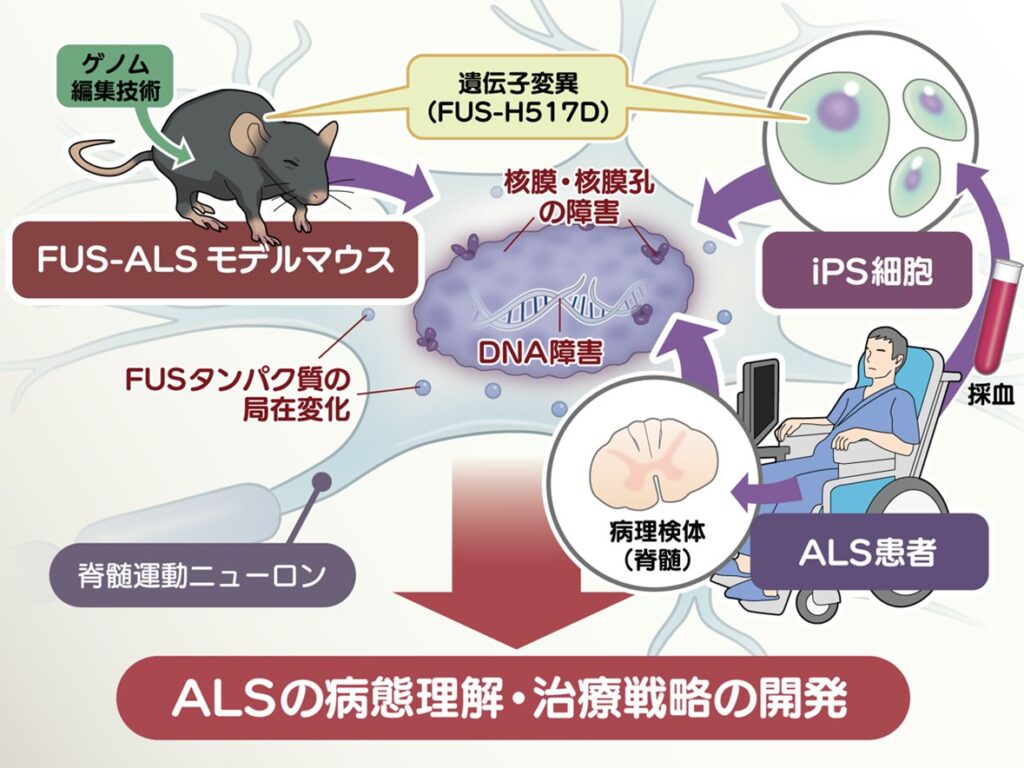
我々は、筋萎縮性側索硬化症の新規モデルマウスをゲノム編集技術CRISPR-Cas9システム(注1)を用いて作成することに成功しました。このモデルマウスには、日本の家族性ALSにおいてSOD1遺伝子(注2)の異常に次いで多いFUS(fused-in sarcoma)遺伝子(注3)の異常(FUS-H517D)に相当する点変異を導入しました。今回作成したマウスは、従来のトランスジェニックマウス(注4)とは異なり、ゲノム編集技術を用いて内在性のFUS遺伝子の遺伝子変異を加えることで、より生理的な条件で、患者さんに近い疾患モデルとして病態解析や治療薬開発への応用が可能です。このモデルマウスは、加齢とともに歩行などの運動機能障害を示し、脊髄運動ニューロンの減少に加え核膜および核膜孔の障害、DNA障害を認めました。
さらに、我々が確立した同一の変異(FUS-H517D)をもつALS患者さん由来のiPS細胞(注5)から分化誘導した運動ニューロンでも核膜および核膜孔の障害を明らかにし、RNA-seq解析(注6)ではFUS-H517D変異をもつ運動ニューロンにおいて、核膜および核膜孔に関連する遺伝子の多くが有意に発現低下していることが示されました。さらに、ALS患者さんの死後組織でも脊髄運動ニューロン神経の核膜および核膜孔の障害が示されました。
神経細胞において本質的である核膜の障害は、細胞の生存維持に決定的な要因となります。この核膜障害の改善なくしては、ALSの治癒は望めません。この研究成果では、ALSで見られる遺伝子異常を再現したゲノム編集マウスが、加齢に伴い運動機能障害を示し、脊髄運動ニューロンにおける核膜および核膜孔の障害がALSの決定的な病態メカニズムであり、新規治療ターゲットであることが示されました。ゲノム編集マウス・iPS細胞と患者病理検体といった研究材料を組み合わせることで、ALSの病態理解を深め、治療薬開発が飛躍的に推進されます。
【用語解説】
(注1)CRISPR-Cas9システム
特定のDNA配列を標的として正確に切断し、その部分に新しい遺伝子を挿入したり、不要な遺伝子を削除したりする技術。これは、ガイドRNA(gRNA)と呼ばれる分子がCas9という酵素を特定のDNAの場所に誘導し、そこでDNAを切断して遺伝子編集を行う仕組み。
(注2)SOD1遺伝子
「スーパーオキシドジスムターゼ1(Superoxide Dismutase 1)」という酵素をコードする遺伝子で、この遺伝子に変異が生じると筋萎縮性側索硬化症を発症する。日本では、家族性ALSの中で最も多い原因遺伝子。
(注3)FUS(fused-in sarcoma)遺伝子
日本では、家族性ALSの中でSOD1遺伝子変異に次ぐ2番目に多い原因遺伝子。ALSでは核移行シグナル(細胞質から核への移動に必要な部分)に変異が集中している。FUS-H517Dはこの核移行シグナルにおける遺伝子変異であり、517番目のアミノ酸であるヒスチジンがアスパラギン酸に置き換わっている。
(注4)トランスジェニックマウス
外部から特定の遺伝子を導入し、その遺伝子が機能するように遺伝子改変されたマウス。導入した遺伝子が想定外の場所で発現し、ほかの遺伝子に影響を与える可能性があり、予期しない結果が生じることもある。
(注5)iPS細胞
体細胞に特定因⼦を導⼊することにより樹⽴される多能性幹細胞であり、ヒト⼈工多能性幹細胞(human induced pluripotent stem cell)を用いて、唯一患者さんの遺伝子情報をすべて受け継いだ病気のモデルを作成することができる。
(注6)RNA-seq解析
遺伝子転写産物(mRNA)の発現を網羅的かつ定量的に解析するための分子生物学的手法。
参考文献
Multiple lines of evidence for disruption of nuclear lamina and nucleoporins in FUS amyotrophic lateral sclerosis.
Okada K, Ito D, Morimoto S, Kato C, Oguma Y, Warita H, Suzuki N, Aoki M, Kuramoto J, Kobayashi R, Shinozaki M, Ikawa M, Nakahara J, Takahashi S, Nishimoto Y, Shibata S, Okano H.
Brain. 2024 Nov 4;147(11):3933-3948. doi: 10.1093/brain/awae224.

