はじめに
フォンタン手術は、先天性の心臓病(単心室症など)で、低酸素血症を改善するために行われる、重要な手術です。しかし、その特殊な循環のために、時間がたつと様々な合併症が現れることがあります。
そのひとつがたんぱく漏出性胃腸症(Protein Losing Enteropathy:PLE) です。
これは、体に必要なたんぱく質(特にアルブミン)が腸から漏れ出してしまう病気で、フォンタン手術を受けた患者さんの約1割に起こります。重い場合は、栄養不良や強いむくみ、体のだるさ、感染にかかりやすくなるなどの症状を引き起こし、輸血や入院を繰り返さなければならなくなります。生活の質(Quality of Life)も大きく下がってしまうため、とても深刻な合併症です。しかし、これまでその病態や治療法は、明らかになっておりませんでした。
病気のしくみ
最近の研究で、この病気の原因がだんだん分かってきました。
- フォンタン手術後は、心臓に戻る血液の圧力(中心静脈圧)が高くなります。
- すると、肝臓がうっ血することで、通常の20〜30倍ものリンパ液をつくり、たくさんの異常なリンパネットワークが形成されます。
- 増加したリンパの流れが「肝臓と十二指腸の間のルート」を通り、腸内に新しい出口をつくってしまうと、リンパ液が腸に漏れ出してしまいます。
- この状態(リンパ瘻)ができることで、PLEが起こるのです。
つまり「肝臓でつくられたアルブミンをたくさん含むリンパ液が腸に漏れる」ことが、この病気の正体であるということが、分かってきました(図1)。

肝臓から十二指腸へ多量のリンパ液が漏れることでPLEを発症する(緑矢印)。
新しい治療法―肝内リンパ管塞栓術―
2017年にアメリカのフィラデルフィア小児病院から「漏れ出しているリンパネットワークを詰めて漏れをなくす」という治療法が報告され、大きな注目を集めました。これが 肝内リンパ管塞栓術です。
慶應義塾大学病院でも放射線診断科と協力して2020年からこの治療を導入し、これまで10人以上に行いました。そのうち約6〜7割の患者さんで症状が大きく改善しています。
治療の流れ
1.全身麻酔をかけて、細い針で肝臓を刺し、肝臓内のリンパ管を造影します(図2)。

肝臓のリンパ管を穿刺し、造影した像。異常なリンパネットワークが十二指腸に向かって流れる(黄色矢印)。
2.青い色素を注入して、十二指腸にリンパ液が漏れているかどうかを確認します(図3)

肝臓内に注入した青色色素が十二指腸内に漏れる様子が観察される。
3.漏れている経路(リンパ瘻)が見つかれば、その場で液状の塞栓物質を注入して流れないように固めてしまいます。
- 手技はおよそ2〜3時間で終わります。
- 傷口は針の跡だけで済み、大きな切開は不要です。
- 入院は1週間ほどで、多くの方が退院できます。
- うまくいけば、2〜3週間後から血液中のアルブミンが上がってきます。
患者さんの声
治療後に改善した患者さんからは、
- 「輸血や入院をしなくなった」
- 「むくみが取れて体が軽くなった」
- 「歩けるようになった」
などの声をいただいています。私たち医療チームにとっても、大きな励みになっています。
さいごに
これまでフォンタン術後のPLEは「原因がよく分からない難しい病気」で、栄養管理や薬で支えるしか方法がありませんでした。しかし今は、「腸に漏れている場所を特定して、直接治療する」時代に変わりつつあります。
私たちは、フォンタン術後の患者さんとご家族が少しでも安心して生活できるように、この新しい治療をさらに発展させ、より多くの方に届けていきたいと考えています。
PICUとは何か
PICU(Pediatric Intensive Care Unit:小児集中治療室)とは、子どもを対象にしたICU(Intensive Care Unit:集中治療室)のことです。子どものICUといえば、多くの方が最初にNICU(Neonatal Intensive Care Unit:新生児集中治療室)を思い浮かべるかもしれませんが、PICUはNICUと多くの点において違いがあります。NICUは、母親から生まれた新生児が、様々な問題(例えば早産や低出生体重など)によって環境に適応できない場合に治療を行うICUです。一方、PICUは、重い病気や怪我をした子どもや、リスクの高い手術を行った直後の子どもに対して治療を行うICUで、新生児からおおむね中学生くらいまでの幅広い年齢の患者さんを対象にしています。さらに、成人ICUとの役割分担は年齢によってなされます。ICU管理が必要な重症患者さんが子どもであればPICU、大人であれば成人ICUで治療すると考えると分かりやすいでしょう。
PICUに求められる要件とは
医療の進歩は日進月歩といわれますが、医療が高度で複雑なものになるにつれて、リスクが増大するのもまた事実です。ICUの役割は「複雑でリスクの高い医療を安全に行うこと」であるともいえます。そのためには、人と物・設備が常に重症患者さんの治療に最適化されている必要があります。物や設備に関しては、ICU管理に必要な医療資機材として、重症患者さんに特化した医療用モニターや、人工呼吸器、ECMO(Extra-corporeal Membrane Oxygenation:体外式膜型人工肺)などがイメージしやすいでしょう。
では、人に関してはどうでしょうか。まず、ICUには一般病棟よりも多くの医師・看護師が配置されます。医師は終日(24時間365日)のICU内滞在が義務付けられており、ICU内のあらゆる問題に対して即座に対応できる体制となっています。また、看護師は患者さん2人に対して1人以上が割り当てられ(2対1看護)、より手厚い看護体制となっています。それ以外の職種を含めた「チーム医療」も、ICUにとっては重要です。チーム医療とは、多くの専門領域に細分化された現代の医療において、多種多様な専門職が1人の患者さんに関わるシステムです。これにより、患者さんは多くの専門職からそれぞれの専門領域を背景とした高度な医療的介入を受けることができ、医療の質の向上が期待できます。特にICUにおいては関わる職種が多く、集中治療専門の医師や看護師に加え、他部門の医師、薬剤師、医用工学技士、放射線技師、臨床検査技師、理学療法士、栄養士、事務職、ソーシャルワーカーなどが必要に応じてチームに加わります。
しかし、良いチーム医療は単に専門職が集まるだけでは成し遂げられません。背景とする専門領域が違えば、判断や優先順位が異なることは珍しくないため、多くの専門職の意見を集約したうえで、実際に行う医療行為の内容を適切に判断し実行するシステムがなければ、意見の対立や無秩序な指示により診療に支障を来しかえって安全性が損なわれます。これは、ガバナンス(健全な組織運営を行うための統治体制)の重要性と言い換えることもできます。多くのICUにおいては、集中治療医がすべての医療行為に承認を与え、最終的な実施責任を負うことでガバナンスを明確にし、意見の不一致やコミュニケーションエラー、責任の不明確さから生じるリスクを最小化しています。同時に、常日頃から多職種がそれぞれの立場を理解・尊重し、円滑な人間関係の構築に努めることも重要です。
子どもを対象にしたICUであるPICUの場合、以上に加えて、子どもの特性にも配慮しなければなりません。医学的な評価や治療に際しては、子どもの解剖学的特徴や生理学的特徴、疾病構造や有病率(特に大人との違い)を理解し、子どもの医療に熟練する必要があります。また、子どもの発達段階や心理的・精神的特性の理解、親や家族との関係性も重要です。したがって、PICUの医師には集中治療領域に加え小児科をはじめとする小児に関連した様々な領域の知識や経験も求められます。同様に看護師においても、重症の子どもに対する看護を行いますので、専門的な知識や経験が必要です。診療チームには、保育士やチャイルドライフスペシャリストが加わる場合があり、子どもの患者さんの心理的なサポートを担います。
慶應義塾大学病院 小児ICUについて
慶應義塾大学病院のPICU(「小児ICU」と称します)は、全国で39施設、東京都内で5施設(大学病院に限っては3施設)のPICUのうちの1つで、2019年に開設されました。院内に設置された周産期・小児医療センターの枠組みを中心として多くの診療科や専門職が密接に関わり、小児ICU専従医師を中心に関係部門と良好なコミュニケーションを保ちながら、診療を行っています。
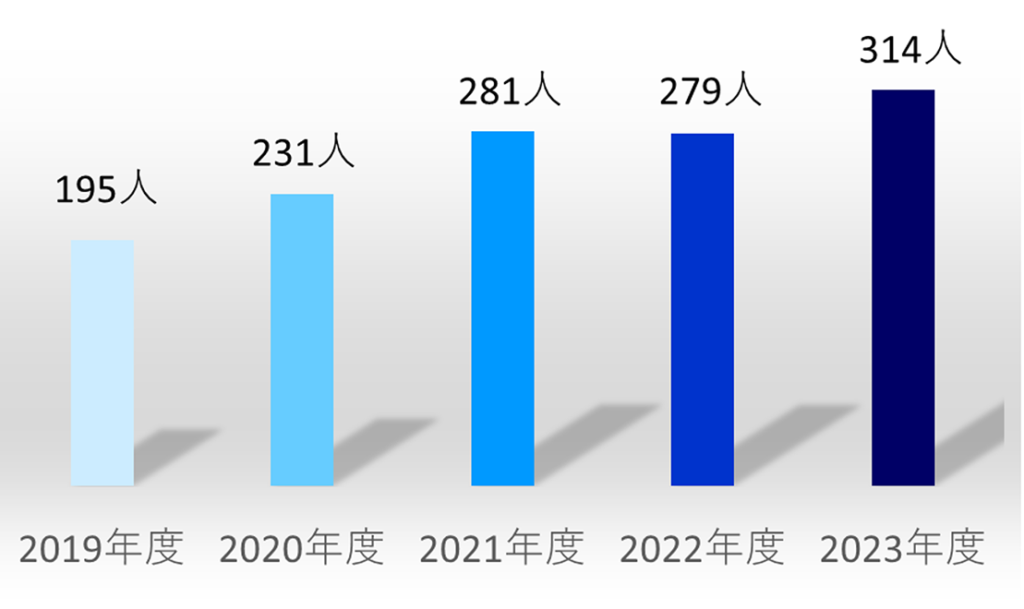
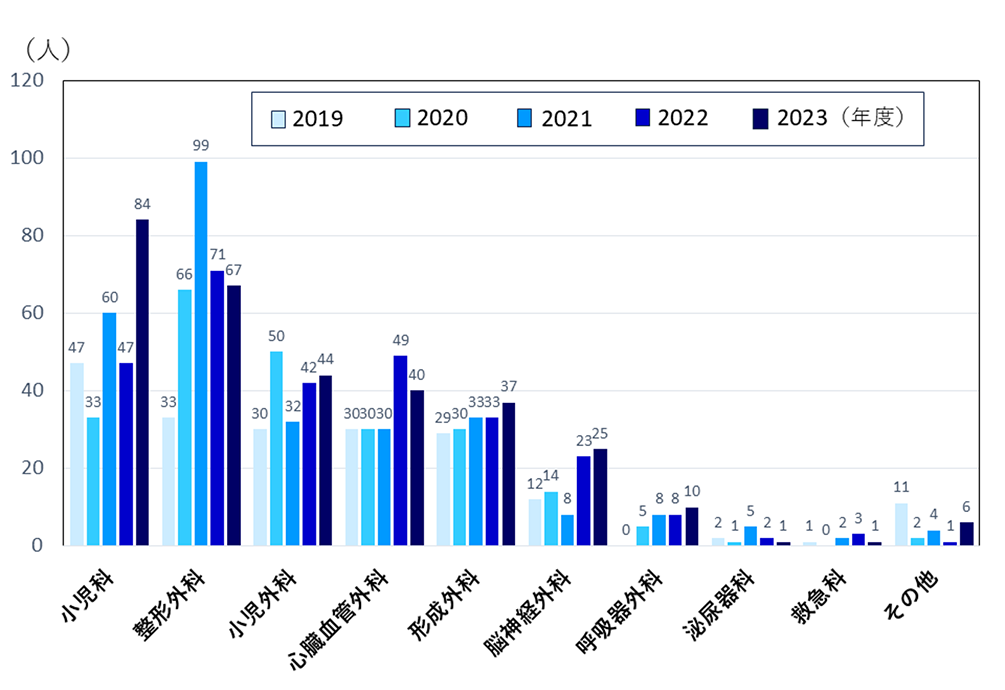
小児ICU入室患者数は開設初年度(2019年度)の195人から年々増加し、2023年度は314人となっています(図1)。診療科を問わず患者さんを受け入れており、2023年度の診療科別内訳では、患者数順に小児科、整形外科、小児外科、心臓血管外科、形成外科、脳神経外科、呼吸器外科となっています(図2)。また、術後患者さんの割合が多いこと(2023年度では全体の67%)、当院にかかりつけの基礎疾患をもつ患者さんの割合が多いことも当施設の特徴です。
小児ICUの病床数は、2025年2月に4床から6床に増床されました。この増床に伴い、ICU管理に特化した電子カルテ重症部門システム(フィリップス社 ACSYS)を新たに導入し、従来の電子カルテより安全かつ効率的に重症患者さんの管理を行えるようになりました。また、病床数に応じた看護師の増員により、常に3人以上の看護師が小児ICUに常駐するようになり、より安全なICU環境が実現しました。さらに、ICU病床の流動性が高まることで、例えば小児病棟などで予定外に重症の患者さんが発生した場合においても、小児ICUにおいて余裕をもった受け入れが可能になり、小児部門全体の安全性が向上します。近隣医療機関や大学関連病院で発生した重症小児患者さんの受け皿としての機能も強化されますので、地域の小児医療全体の底上げにも貢献できると考えています。
診療以外では、学生や研修医に対する教育や、臨床研究にも力を入れており、教育機関や研究機関としての機能も備えています。
増床により機能が強化された小児ICUは、引き続き当院における小児診療の要としての役割を果たし、子どもの患者さんとそのご家族の安全と安心のために尽くして参ります。

はじめに
15歳未満で起きるがんのうち、最も頻度が高いのは白血病です。小児白血病の約7割を占める急性リンパ性白血病(Acute Lymphoblastic Leukemia:ALL)は、白血球の種類のひとつであるリンパ球が成熟する過程で遺伝子異常が起こり、未熟なリンパ球の異常な増殖を特徴とする血液のがんです。この30年の間にALLの治療成績は飛躍的に向上し、5年以上の生存が9割以上の患者さんで期待できるようになりました。また、ALL細胞がもつ遺伝子異常や初期治療への反応性などの情報を組み合わせることで、長期生存を見込める患者さんを予測できるようになりました。しかし、予後不良の予測因子をもつ患者さんの長期生存率は依然として50%以下であり、治療成績向上に貢献する新規治療の開発が望まれてきました。
CAR(Chimeric Antigen Receptor)-T細胞は、キメラ抗原受容体遺伝子改変T細胞の略称で、がん細胞に特徴的な分子に結合する部分とT細胞を活性化する部分を融合させた「キメラ抗原受容体」を遺伝子導入した細胞です。小児ALLは、CAR-T細胞療法が初めてがん免疫療法として適用された疾患です。CAR-T細胞は、がん細胞を集中的に攻撃できる、投与後に体内で増殖、維持されるためがん細胞を継続的に攻撃できるという特長があり、従来の抗がん剤よりも高い治療効果をより少ない副作用で得られることが期待できます。
小児の再発・難治性ALLに対するCAR-T細胞療法は、2017年に米国食品医薬品局の承認を取得し、日本でも2019年にチサゲンレクルユーセル(キムリア®)が保険承認されました。慶應義塾大学病院は、2019年にキムリア®治療提供可能施設に認定され、小児科では2020年からキムリア®を使った治療を行っています。
CAR-T細胞療法の対象となるALLの患者さん
当科で治療提供可能なCAR-T細胞療法は、キムリア®です。キムリア®はCD19という分子を標的としてがん細胞を攻撃するため、ALL患者さんのうち、がん細胞の表面にCD19が発現しており、従来の治療後に再発された患者さん、難治性の患者さんが対象となります。キムリア®治療は認可を受けた施設でのみ行われています。詳しくは、主治医にお問い合わせください。
CAR-T細胞療法の実際(図1)
まず、CAR-T細胞のもととなるTリンパ球を患者さん自身から採取します。約2~3時間かけて、体外に取り出した血液から必要なリンパ球を専用の器械を用いて採取し、残りの血液を体内に戻します。採取されたリンパ球は液体窒素で凍結保管され、これをCAR-T細胞を製造する工場へ送り届けます。
CAR-T細胞が製造され、再び治療施設に戻ってくるまでの期間、病気の進行を抑えるために化学療法を行います(ブリッジング治療)。ブリッジング治療の内容はこれまでの経過を踏まえ、治療効果と副作用のバランスを考えて選択します。また、ブリッジング治療で用いる薬剤がCAR-T細胞の治療効果を弱めることがないように、CAR-T細胞投与の数日から数週間前(薬剤の種類により期間が異なります)にはブリッジング治療を終了しておく必要があります。CAR-T細胞投与前に正常リンパ球が一定量以上残っている場合は、3~4日間のリンパ球除去療法を行い、2日以上の間隔をあけてCAR-T細胞を投与します。
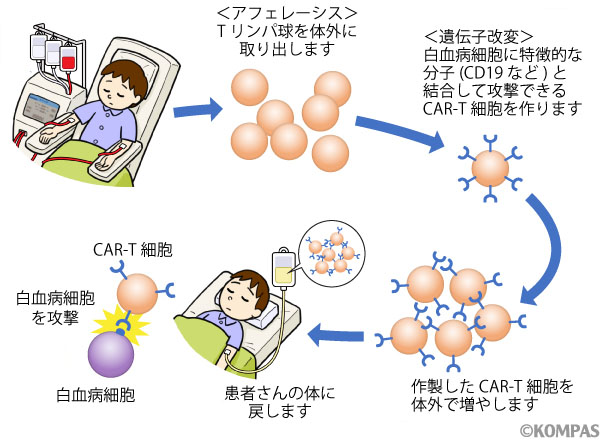
図1.CAR-T細胞療法の流れ〜製造から投与まで
CAR-T細胞療法の合併症
インフュージョンリアクション(急性輸注反応)
CAR-T細胞の投与時に発熱、皮膚のかゆみ、吐き気、呼吸困難などの症状が出る場合があります。これらの症状を予防するため、解熱剤や抗ヒスタミン剤を使用します。
サイトカイン放出症候群
CAR-T細胞が放出するサイトカインによって起こる全身性の炎症の症状で、発熱から始まり、重症化すると心不全や呼吸障害、腎不全、肝機能障害などを起こします。発熱の頻度は40~80%と報告されています。症状や重症度に応じて、輸液、解熱剤、酸素、昇圧剤などの治療を行うほか、インターロイキン6の阻害剤(トシリズマブ)やステロイドなどの炎症を抑える薬剤の投与も行われます。
免疫エフェクター細胞関連神経毒性症候群
CAR-T細胞療法の合併症として治療後、様々な時期に神経の異常(頭痛、意識障害、麻痺、失調、けいれんなど)がみられます。その頻度は0~50%と報告により様々です。神経系の異常を合併した患者さんの髄液内でCAR-T細胞が検出されるとの報告があり、症状の発生に何らかの関わりをもつと考えられています。
低ガンマグロブリン血症
CD19を目印として細胞を攻撃するCAR-T細胞は、ALL細胞と同様にCD19をもつ正常Bリンパ球も攻撃するため、B細胞が分泌する免疫物質ガンマグロブリンが体内で不足する低ガンマグロブリン血症を合併します。この副作用への対応として、定期的なガンマグロブリンの補充が必要になることが多いです。
CAR-T細胞療法の効果
CAR-T細胞療法が臨床応用される前は、難治性ALLに対する治療は造血細胞移植が中心でした。CAR-T細胞療法は、従来の化学療法では寛解が得られない患者さんの寛解率を上昇させるだけでなく、造血細胞移植と比較して治療後の生活の質をより早期に改善することが期待できます。
CAR-T細胞の今後と当院の取り組み
小児白血病の中でも、難治性のT細胞性ALLや急性骨髄性白血病(Acute Myeloid Leukemia:AML)の治療成績は、B細胞性ALLに比べて不良です。このため、国内外でこれらの難治性白血病に対するCAR-T細胞の開発研究が進められています。
当院では、キムリア®治療提供可能施設として適応のある小児ALL患者さんを積極的に受け入れ、スムーズにCAR-T細胞療法を実現できるよう、近隣の施設と密な連携体制を取っています。
はじめに
2022年4月より、慶應義塾大学病院小児科では小児リウマチ性疾患や自己炎症性疾患に関する精査・加療を専門に行う「小児リウマチ・膠原病外来」を開設しています。
小児リウマチ・膠原病外来では、若年性特発性関節炎や全身性エリテマトーデスといったリウマチ性疾患と診断された患者さんの治療だけでなく、「リウマチ疑いと言われたけど、どうしたら良いか分からない」という方へのセカンドオピニオンや、「原因不明の発熱を繰り返している」「発熱がずっと続いている」患者さんへの原因検索も行います。以下に小児リウマチ・膠原病外来の診療内容について具体的にお示しします。
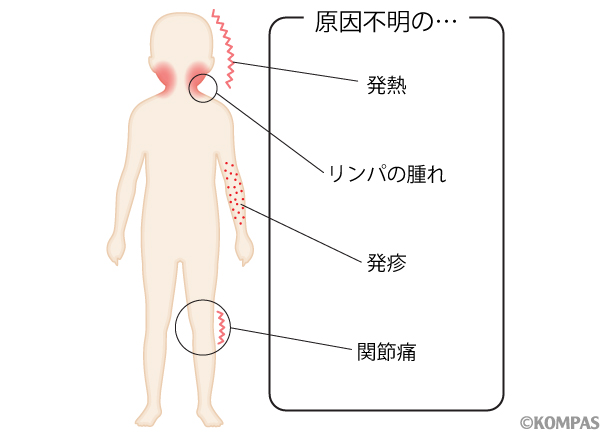
小児リウマチ性疾患、自己炎症性疾患とは
小児リウマチ性疾患
リウマチ・膠原病は結合組織に起こる炎症によって、全身の様々な部位に障害が起きる病気の総称です。その中で小児期(16歳未満)に発症したものを小児リウマチ性疾患と呼びます。
具体的な病名は若年性特発性関節炎(若年性関節リウマチ)、全身性エリテマトーデス、全身性強皮症、多発性筋炎/皮膚筋炎、シェーグレン症候群、ベーチェット病などです。また、血管の炎症が主体となる川崎病、IgA血管炎(ヘノッホ・シェーンライン紫斑病)、高安動脈炎、ANCA関連血管炎(顕微鏡的多発血管炎、多発血管炎性肉芽腫症)などもこの疾患群に含まれます。
自己炎症性疾患
近年、周期的に発熱を繰り返す疾患や長期に発熱を来す疾患の中に免疫に関連した遺伝子の異常により発症するものがあることが分かってきており、自己炎症性疾患と呼ばれています。具体的には家族性地中海熱やPFAPA症候群(周期性発熱・アフタ性口内炎・咽頭炎・頚部リンパ節炎症候群、原因遺伝子不明)、慢性再発性多発性骨髄炎/慢性非細菌性骨髄炎(CRMO/CNO、原因遺伝子不明)などがあります。これらの疾患も小児リウマチ・膠原病外来で対応いたします。
治療の概要
小児リウマチ性疾患はステロイドと免疫抑制剤による治療が中心でしたが、2008年にトシリズマブという生物学的製剤が全身型および多関節型若年性特発性関節炎に対して承認されて以来、次々と生物学的製剤の導入が進み、患者さんの予後改善、QOL上昇につながっています。
生物学的製剤とは、バイオテクノロジーを用いて製造された薬剤で、特定の分子を標的とした治療を行います。
表1.生物学的製剤の種類と適応疾患
|
生物学的製剤 一般名 |
標的分子 |
適応疾患 |
|---|---|---|
| トシリズマブ | IL-6レセプター | 若年性特発性関節炎、大動脈炎など |
| エタネルセプト | TNF-α,β | 若年性特発性関節炎 |
| アダリムマブ | TNF-α | 若年性特発性関節炎 |
| アバタセプト | CD80/86 | 若年性特発性関節炎 |
| カナキヌマブ | IL-1β | クリオピリン関連周期性症候群、若年性特発性関節炎など |
| インフリキシマブ | TNF-α | 川崎病、ベーチェット病など |
生物学的製剤はリウマチ性疾患に対して高い治療効果が期待できる薬剤ですが、その使用にあたっては十分な専門的知識と経験が必要であり、小児リウマチを専門とする医師の指導下での使用が推奨されています。当外来では小児リウマチを専門とする医師が治療を担当いたします。
当外来の特徴
小児科医が担当しますので、疾患そのものや治療薬の副反応によって生じる小児特有の様々な問題に対し真摯に対応いたします。また、当院リウマチ・膠原病内科とも連携を取り、移行期医療もスムーズに行えるよう尽力いたします。
脊髄性筋萎縮症とは
体の筋肉を動かす指令を出す運動神経細胞が変化ないしは消失することにより、主に筋肉に症状が現れる生まれつきの疾患です。早い場合には出生直後から、手足をあまり動かさない(floppy infantと呼ばれます)、呼吸とともに胸郭が凹凸するなどの症状で気づかれ、筋力が低下したり、筋肉がやせ細ったり(筋萎縮)、哺乳や食べ物の飲み込みが難しいといった症状が現れます。症状が進むと、呼吸を維持するのが難しくなり、気管切開や人工呼吸器が必要になります。重症の場合には、治療が行われなければ、数か月以内に死亡します。一方で、この疾患では一般に知能は侵されません。
原因
この疾患の患者さんのほとんどは、運動神経の生存や機能維持に必要なタンパク質を産生するSMN1遺伝子を持っていない、あるいは変化していることが原因です。SMN1遺伝子は、運動神経細胞の生存や機能維持に必要なSMNタンパクを作るために必要です。SMNタンパクが不足すると、運動神経細胞の機能を維持できなくなり、上記のような筋肉の症状を引き起こします。診察上は、打腱器で膝や肘を叩いでも手足が反応して動かない(深部腱反射の消失あるいは減弱といいます)が特徴です。
この疾患は、通常2つあるSMN1遺伝子の両方の働きが失われたときに発症します(常染色体劣性遺伝病といいます)。片方のSMN1遺伝子の機能が失われただけでは発症しません(保因者といいます)。脊髄性筋萎縮症の子供を持つ両親は通常保因者であり、この両親から、再度脊髄性筋萎縮症を持つ子供が生まれる確率は25%です。
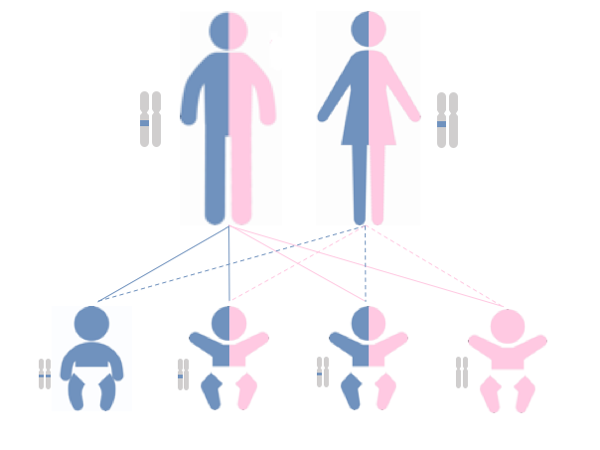
図1
常染色体劣性遺伝病では、ともに変化を持った遺伝子を受け継いだときにのみ発症する(1番左の青い児)。片方だけが変化を持つ遺伝子である場合は、発症せず、保因者という(真ん中の2人)。すなわち、保因者の両親からは、25%の確率で罹患児が出生する可能性がある。25%の確率で変化を持つ遺伝子が引き継がれない(一番右の桃色の児)。
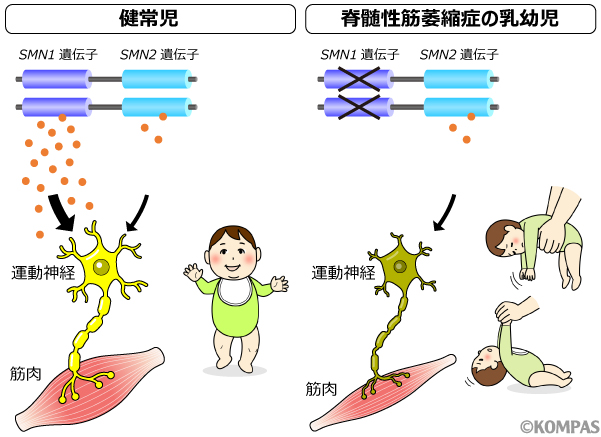
図2
左図: 健常児では、SMN1遺伝子から作られるSMNタンパク(オレンジの丸)により運動神経が発達する。
右図: 脊髄性筋萎縮症の乳幼児では、生まれつきSMN1遺伝子が欠失しているあるいは機能しないため、十分な量のSMNタンパクが作られない。そのため、運動神経が発達できず、筋力が低下する。
治療法
アンチセンス核酸医薬品:ヌシネルセン(商品名スピンラザ®)
人の体には、SMN1遺伝子とよく似た配列を持つSMN2遺伝子が存在します。健常な人では、SMN1遺伝子によって十分な量のSMNタンパクを作ることができるため、SMN2から作られるSMNタンパクは、体内ですぐに分解される機構が働いています。
ヌシネルセン(スピンラザ®)は、SMN2遺伝子の転写産物の特定の部位に結合するように設計された核酸(アンチセンス核酸といいます)です。この特殊な核酸により、SMN2遺伝子から作られるSMNタンパクを分解する機構を阻害することで、体内のSMNタンパクを増やす治療です。髄液注射が行われ、数か月おきに定期的に治療を繰り返すことが必要です。2017年から日本でも保険診療として行われています。
- SMN1遺伝子の欠失又は変異を有していることに加えて、SMN2遺伝子の数の確認が必要です。
遺伝子治療:オナセムノゲンアベパルボベクゾル(商品名:ゾルゲンスマ®)
人工的に作成したSMN遺伝子を外部から患者さんの体内に導入し、不足しているSMNタンパクを患者さん自身が安定して作ることができるようにする治療法です。SMN遺伝子を治療用ベクター(治療のために設計された遺伝子の運搬体で、アデノ随伴ウイルス9型:AAV9と呼ばれます)という病原性のない殻の中に入れて、目的の運動神経細胞まで届けられるように設計されています。
AAV9によって運動神経細胞に導入されたSMN遺伝子は、神経細胞内に留まります。これにより、患者さん自身の細胞が、半永久的にSMNタンパクを作れるようになります。なお、導入されたSMN遺伝子は、もともと患者さんが持っている染色体からは離れて留まるため、患者さんがもともと持っている体質に影響を与える可能性は低いと考えられています。2020年5月から、日本でも保険診療として行われています。ゾルゲンスマの治療は、1回の点滴で治療が完結しますが、以下の点に注意する必要があります。
- 患者さんを強制的にAAV9に感染させる必要があります。一定期間(2か月程度)、副腎皮質ステロイドを内服していただき、免疫抑制状態にする必要があります。
- AAV9には病原性や増殖性がなく、ヒトを含めた生物に悪影響を与える可能性は極めて低いことが分かっていますが、患者さんの体液(鼻水、よだれ、涙)や排泄物(嘔吐物、尿、糞便)には、1か月程度はAAV9が排出されますので、その間、AAV9の拡散を最小限にするための対策が必要となります。
- 投与時に2歳未満の患者さんのみが治療対象となります。
- 事前の検査で抗AAV9抗体を持っている患者さんには投与ができません。
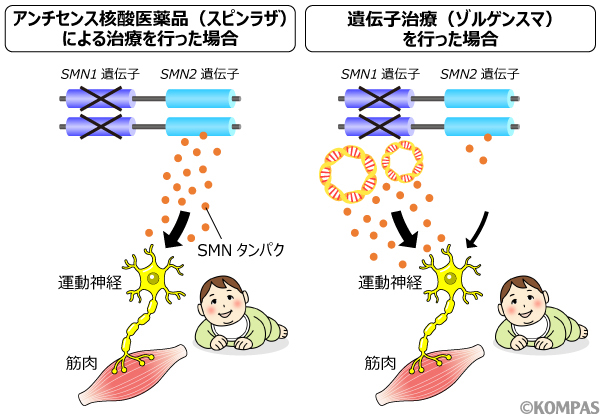
図3
左:アンチセンス核酸医薬品(スピンラザ)は、SMN2遺伝子によって作られるSMNタンパクを増やすことで運動神経の発達を促進する。
右:遺伝子治療(ゾルゲンスマ)は、体外から導入したSMN遺伝子(黄色とオレンジの輪)により体内で持続的にSMNタンパクを作れるようにすることで、運動神経の発達を促進する。
治療効果
いずれの治療法も、治療開始の年齢が早いほど効果が大きいことが報告されています。また、いずれの治療法も永続的な人工呼吸が導入されている等、すでに疾患が進行している患者さんへの有効性、安全性は確立していませんので、投与については慎重に判断する必要があります。

左から:田口寛子(臨床遺伝学センター助教)、高橋孝雄(小児科教授)、筆者 (小児科専任講師)

