慶應発サイエンス
日本人のがんゲノム異常の全体像を解明
研究の背景
近年、がんゲノム研究の進歩に伴い、各がん種において発がんを促進する遺伝子異常が多数同定されました。また、個別の遺伝子異常を標的とした薬剤(分子標的薬)の開発が進み、遺伝子異常に基づいて患者さんごとに適切な薬剤を投与することが可能になってきました。
日本では2019年6月より、標準治療が終了となった固形がんの患者さん、局所進行または転移が認められ標準治療が終了となった固形がんの患者さんを対象に、100種類以上の遺伝子を同時に調べる「がん遺伝子パネル検査」(注1)が保険適用されています。この結果、患者一人ひとりのがんの遺伝子異常に合わせた個別化治療(がんゲノム医療)(注2)が飛躍的に進歩しています。保険診療として実施された「がん遺伝子パネル検査」によって得られる遺伝子配列や診療の情報は、患者さんの同意のもと国立がん研究センターがんゲノム情報管理センター(Center for Cancer Genomics and Advanced Therapeutics:以下C-CAT)(注3)に集約・保管されています。
研究の概要
本研究は、C-CATに蓄積された、様々ながん種由来の約5万例のがん遺伝子パネル検査データを解析し、日本人におけるがんゲノム異常(注4)の全体像や特徴、その臨床的有用性(注5)を明らかにしました。
C-CATに登録された48,627例を対象として、がん種横断的にがんの発生・進行などの直接的な原因となるドライバー遺伝子(注6)異常の解析を行い、欧米と比べて日本人に多いがん種(胆道がんや胃がん、子宮頸がんなど)を含めて、日本人におけるがんゲノム異常の全体像を解明しました(図1)。今回対象としたがん遺伝子パネル検査には、309遺伝子の変異を検出するFoundationOne® CDxがんゲノムプロファイル(42,389例)と、124遺伝子の変異を検出するOncoGuideTMNCCオンコパネルシステム(6,238例)が含まれています。
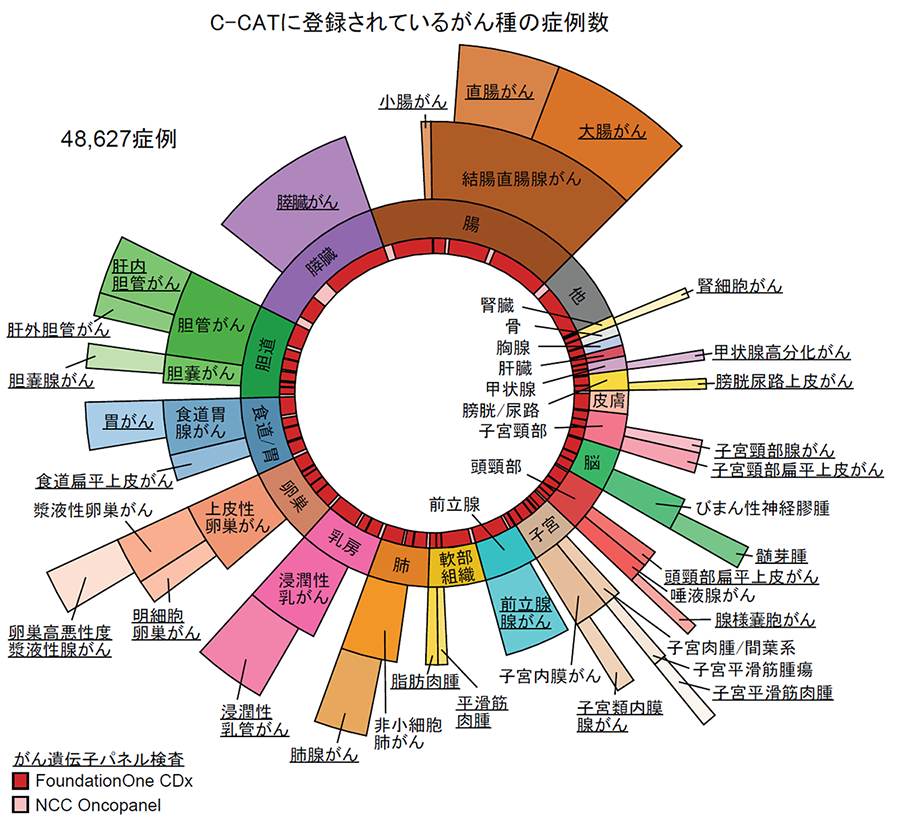
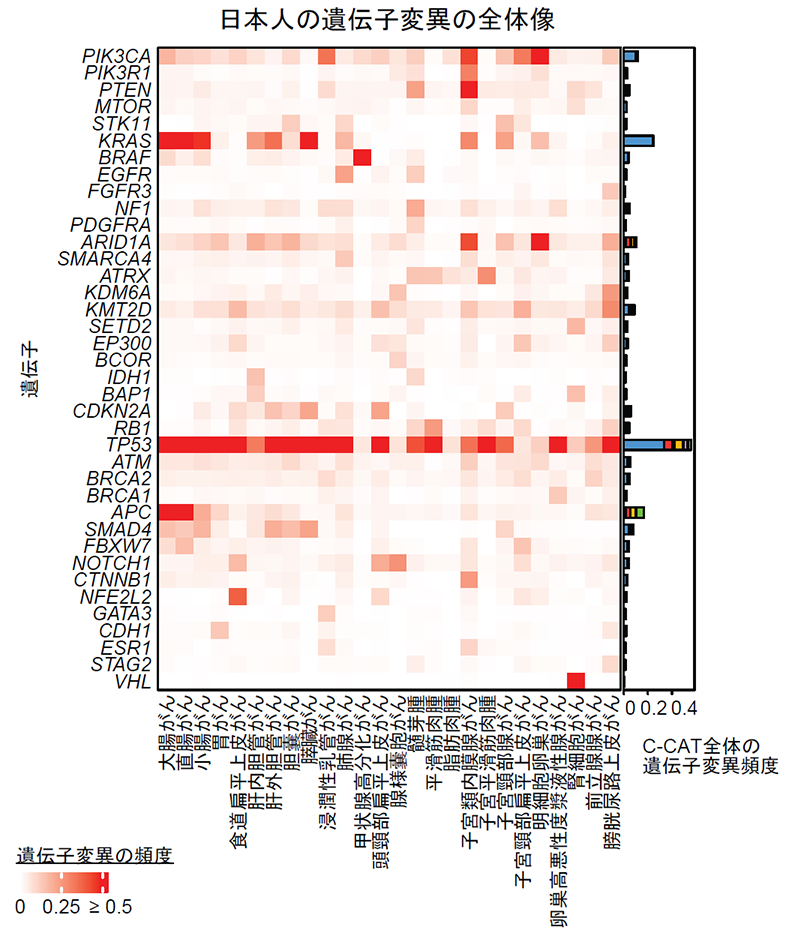
図1. C-CATに登録されている症例の全体像
治療薬の標的となる、または、治療薬の効果予測できるゲノム異常(注7)がある症例は全体の15.3%でした(図2左)。さらに、26種類のがん種を比較したところ、甲状腺がんが最も割合が高く、292人中の249人(85.3%)で治療薬の標的となるゲノム異常が見つかりました(図2右)。
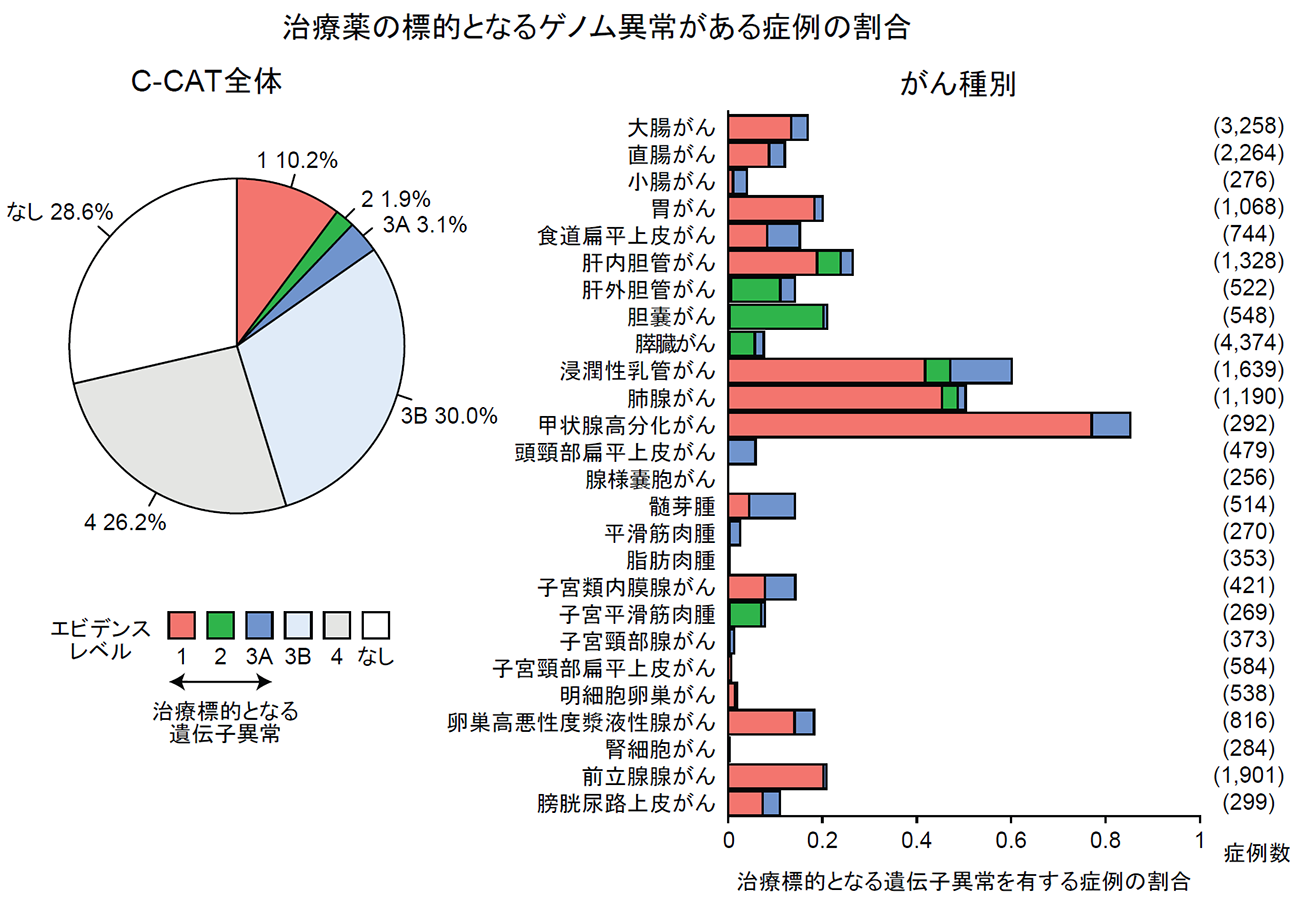
図2.がん遺伝子パネル検査の臨床的有用性
また、米国癌学会シーケンスプロジェクト(GENIE)のがん遺伝子パネル検査データと比較し、10種類のがん種において日本人でTP53遺伝子変異(注8)の頻度が高いことを見出しました(図3左)。検体の採取部位別の比較、米国データ内のアジア人と白人の比較でもほぼ同様の結果がみられ、これより人種間でTP53遺伝子変異頻度に差があることが示唆されました。次に、C-CATの日本人データとGENIEの米国白人データの治療薬の標的となる、または、治療薬の効果予測できるゲノム異常がある症例の割合を比較しました。がん種別に見ると、治療標的となるゲノム異常がある症例数の割合はほぼ同程度でしたが、全体では、日本人に比べて白人の方がこの割合が高いことが分かりました(図3右)。これはC-CATにおいては治療標的となるゲノム異常が少ない膵臓・胆道がんなどの症例が多いためと考えられ、これらのがん種ではゲノム異常を標的とした治療薬の開発が不十分である現状も明らかになりました。
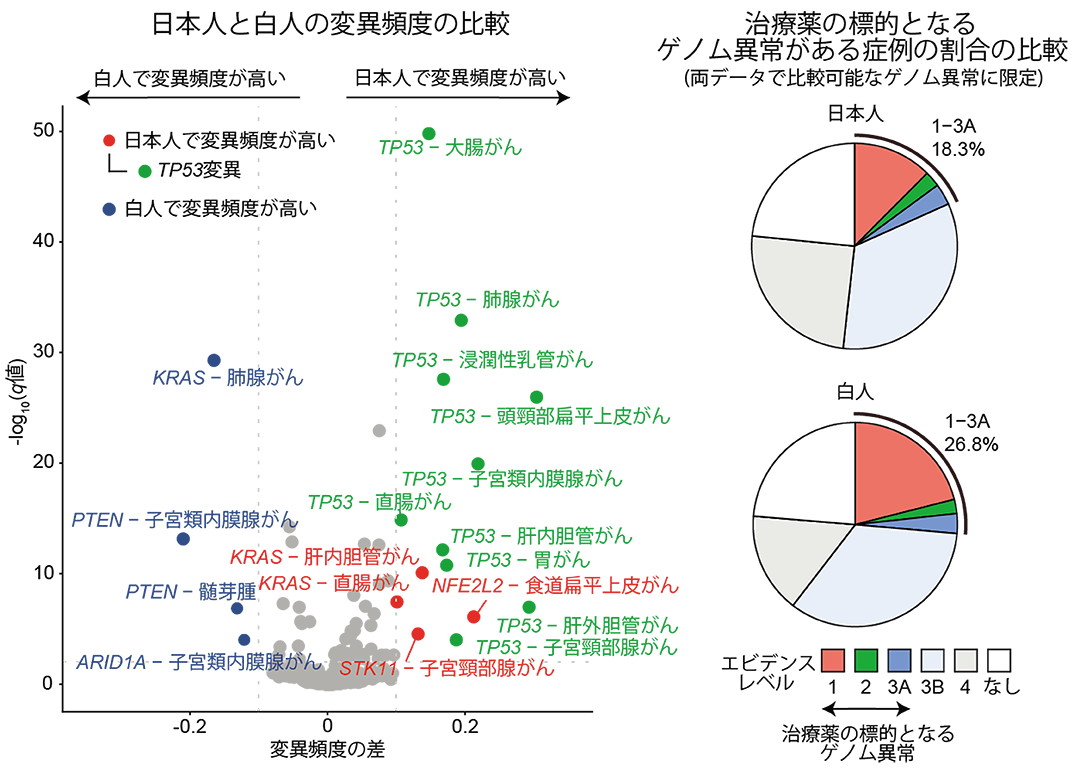
図3.日本人と米国白人の遺伝子異常の比較
ドライバー遺伝子異常間の共存排他関係(注9)を明らかにすることは、発がん経路(注10)やドライバー遺伝子変異の相互作用を推定でき、発がん機構の解明につながると考えられます。そこで、本研究では、日本と米国データを合わせて22種類のがん種における1,790のドライバー遺伝子とがん種の組み合わせの共存排他関係について解析を行いました。この解析は、日本人のC-CAT、米国のGENIEに加えて、米国のがんゲノムアトラス(The Cancer Genome Atlas (TCGA))に登録されている10,074症例のデータを使用しました。共存排他関係を発がん経路ごとに整理すると、エピゲノム制御因子(注11)変異が共存しやすいことを見出しました(図4)。これらの変異の共存は、増殖関連の遺伝子発現変化や細胞増殖への依存関係の変化を介して、がんの生存に有利に働くことを明らかにしました。
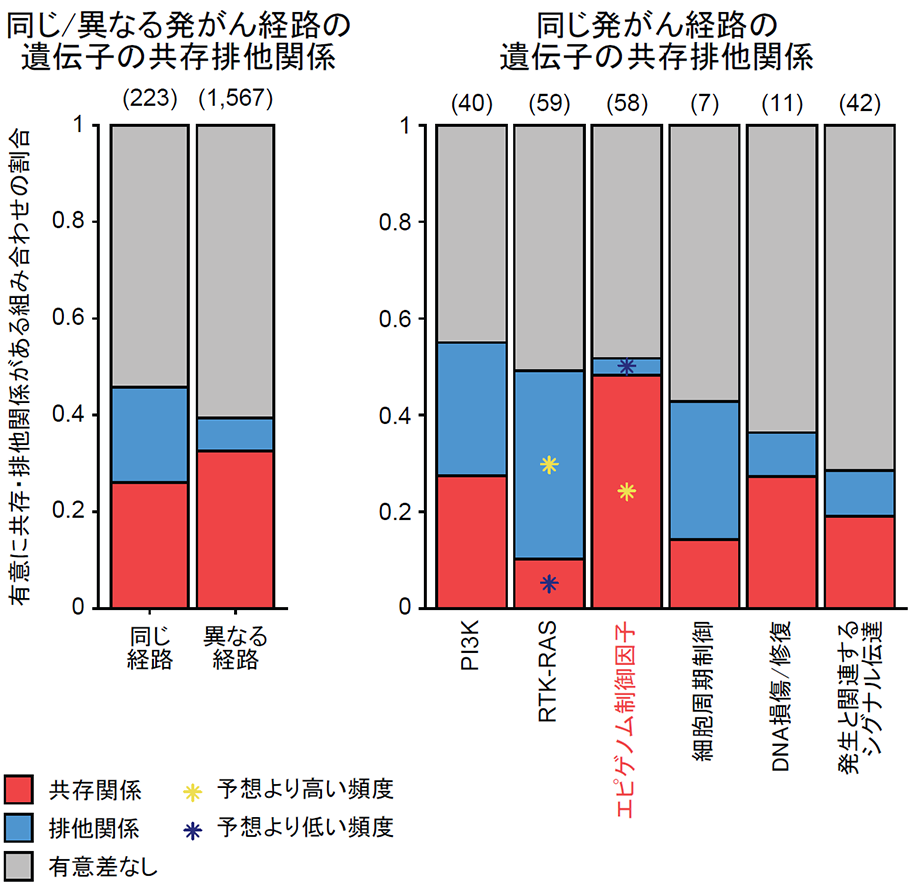
図4.ドライバー遺伝子の発がん経路ごとの共存排他関係
今後の展望
本成果は、日本人においてがん種横断的にドライバー遺伝子異常の全体像を解明した初めての試みであり、アジア最大規模のがんゲノム解析です。さらに、保険診療で実施されているがん遺伝子パネル検査の網羅的解析により、日本におけるがんゲノム医療の状況を提示するものとなりました。これにより、これまで欧米中心だったがんゲノム解析とは異なり、がんゲノム異常の人種差が示されました。本研究は、日本のがんゲノム医療、創薬や臨床試験の基盤となる重要な研究であり、日本人がん患者さんに向けた診断と治療戦略の最適化が必要であることを示唆しています。
【用語解説】
(注1)がん遺伝子パネル検査
がんの組織から100種類以上の遺伝子を同時に調べることにより、がん細胞に起きている遺伝子の変化を検出する検査のこと。この検査の結果を基に、遺伝子異常を標的とした治療を検討できる。
(注2)がんゲノム医療
がん遺伝子パネル検査などによって得られた遺伝子異常の情報に基づいて、一人ひとりに合わせた治療を行う医療。
(注3)がんゲノム情報管理センター(C-CAT)
日本において、保険診療下で実施されたがん遺伝子パネル検査から得られたゲノム情報および診療情報は、一人ひとりの患者さんの同意のもと、C-CATに集約・保管されている。また、一定の条件下に研究者がC-CATのデータの一部を利活用することができる。
(注4)ゲノム異常、遺伝子異常
ゲノム異常とは、ゲノムDNAに生じる変化のことを指し、ゲノムDNAを構成する塩基(アデニン、チミン、シトシン、グアニン)が置き換わったり、挿入したり、欠失したりする変異や構造異常(長さが数十塩基対以上の異常や、染色体をまたいだ異常)、特定のDNAの複製が何度も起こるコピー数異常などが含まれる。ゲノム異常の中で、遺伝子に関連するものは、遺伝子異常と呼ばれる。
(注5)臨床的有用性
がん遺伝子パネル検査などで見つかったゲノム異常の、臨床の治療選択および予後予測における有用性のこと。
(注6)ドライバー遺伝子
がんの発生・進行などの直接的な原因となる遺伝子のこと。ドライバー遺伝子の遺伝子異常は治療標的になり得るため、がんゲノム医療においてドライバー遺伝子異常の同定は重要である。
(注7)治療薬の標的となる、または、治療薬の効果予測できるゲノム異常
治療薬の標的となるゲノム異常はエビデンスレベルと呼ばれる科学的根拠の強さによって、1・2・3A・3B・4に分類され、本研究では、がん治療薬のデータベース(OncoKBTM)を基に、エビデンスレベル1~3Aを、「治療薬の標的となる、または、治療薬の効果予測できるゲノム異常」と定義している。最も科学的根拠の強いエビデンスレベル1のゲノム異常は、当該がん種において、米国食品医薬品局(Food and Drug Administration:FDA)の承認を受けた治療薬における効果予測ができるFDA認定バイオマーカーのことを指す。
(注8)遺伝子変異
遺伝子異常の一種で、短い挿入・欠失や一塩基置換が起こったものを指す。
(注9)共存排他関係
1つのがんで遺伝子変異が一緒に起こりやすい2つの遺伝子を共存関係、1つのがんで同時に遺伝子変異が起こりにくい2つの遺伝子のことを排他関係という。
(注10)発がん経路
がんの増殖や分化などを調節する経路を指す。今回解析対象とした遺伝子は、PI3K経路、RTK-RAS経路、エピゲノム制御因子、細胞周期制御経路、DNA損傷/修復経路、発生に関連するシグナル伝達経路、転写因子、ほかのシグナル伝達経路、その他に分けて分類している。
(注11)エピゲノム制御因子
遺伝子の発現を制御することで細胞の機能調節に関わるもの。
参考文献
Pan-Cancer Comparative and Integrative Analyses of Driver Alterations Using Japanese and International Genomic Databases.
Horie S, Saito Y, Kogure Y, Mizuno K, Ito Y, Tabata M, Kanai T, Murakami K, Koya J, Kataoka K.
Cancer Discov. 2024 May 1;14(5):786-803. doi: 10.1158/2159-8290.CD-23-0902.

左より:斎藤優樹(内科学(消化器)助教)、堀江沙良(内科学(消化器)特任助教)、片岡圭亮(内科学(血液)教授)

