慶應発サイエンス
固形がんに対し強い抗腫瘍効果をもつCAR-T細胞の作成
研究の背景
近年、がん患者さんからT細胞を分離しがん細胞を攻撃できるように遺伝子を導入したT細胞(CAR-T細胞)を、再び患者さんの体内に戻すCAR-T細胞療法(注1)が次世代のがん免疫療法として注目されています。しかしながら、現在CAR-T細胞療法は主にB細胞リンパ腫等の造血器腫瘍に対して高い治療効果がありますが、固形がん(注2)に対する効果は限定的とされます。その原因の一つとして、腫瘍内でがん細胞と戦って消耗することによるCAR-T細胞の「疲弊」化が挙げられ、固形がんに対するCAR-T細胞療法の臨床応用に向けて克服すべき重大な問題と考えられています。
大まかにいって、腫瘍内で疲弊化し攻撃能を失ったT細胞を「終末疲弊T細胞(TEX)」、疲弊化する前のがん細胞と戦っている腫瘍内のT細胞を「疲弊前駆T細胞(TPEX)」、その前の細胞分裂が盛んでTPEXを生み出す細胞を「幹細胞様TPEX」と呼びます(図1)。疲弊前駆細胞(TPEX)は固形がんに対する免疫療法において重要な役割を果たすと考えられています。PD-1抗体などの免疫チェックポイント阻害療法(注3)は疲弊前駆細胞に作用し、抗腫瘍効果を改善させますが、終末疲弊T細胞(TEX)にはあまり効果がありません。したがって、終末疲弊T細胞(TEX)を減らして疲弊前駆T細胞(TPEX)を増やすことが固形がんに対するT細胞療法の有効性を上げる鍵と考えられています。
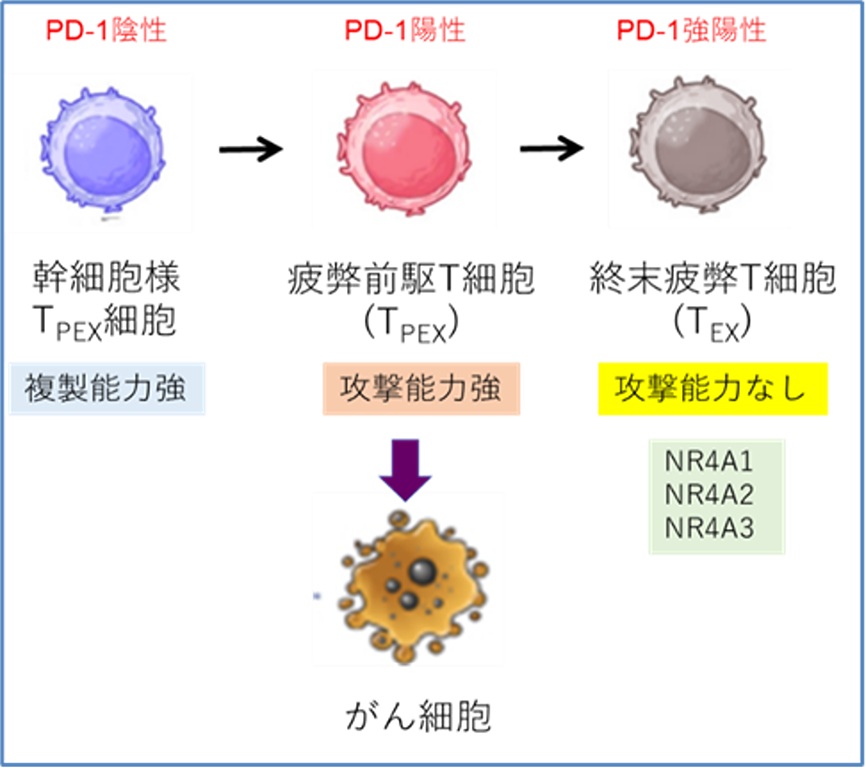
図1.固形がんとの反応によるT細胞の分化様式
T細胞は固形がんなどの慢性的な抗原刺激下において、幹細胞様TPEXから疲弊前駆細胞(TPEX)、さらに終末疲弊T細胞(TEX)へと分化する。疲弊前駆細胞は、がん細胞に対して強い抗腫瘍効果を有する。一方で、終末疲弊T細胞(TEX)は短命で増殖や活性化が起こりにくいため、抗腫瘍効果は期待できず、この細胞が多い患者さんでは免疫療法の効果が乏しいと考えられている。
研究の成果
研究グループは、過去にマウスを用いた研究において、T細胞疲弊を引き起こす遺伝子として転写因子のNR4A(注4)を発見しました(Nature 2019; 567: 530-534)。本研究では、幅広い年齢層の健常者の血液から採取したT細胞からCAR-T細胞を作成し、より強力な抗腫瘍活性を引き出すためにNR4Aの遺伝子を無くした場合の、固形がんに対する反応を調べました。
まずCAR-T細胞と固形がん細胞を長期間培養することで、CAR-T細胞を疲弊化させる実験を行いました。この実験モデルでは野生型のCAR-T細胞はがん細胞と培養を開始した直後は増殖しがん細胞を攻撃して細胞死をもたらしますが、やがて増殖能を失い、2週間の培養後ではがん細胞を殺すことができなくなっていました。その一方で、NR4Aを欠損させたCAR-T細胞は、がん細胞との培養開始直後から強い抗腫瘍効果を発揮しただけでなく、2週間のがん細胞との培養後も疲弊化を免れ、優れた抗腫瘍効果が維持されていました。
遺伝子解析の結果、NR4Aの欠損では「幹細胞様TPEX」に関連する遺伝子の発現が活性化されていると同時に、解糖系やミトコンドリア代謝に関連する遺伝子が活性化されていることが分かりました。ミトコンドリアは細胞のエネルギー源であるATPの産生を行う細胞内器官で、T細胞の場合、疲弊化するとミトコンドリアは萎縮しエネルギー産生ができなくなります。NR4Aを無くすことで、CAR-T細胞ではミトコンドリアの恒常性が改善することにより高いATP産生能を有していることが明らかになりました。この特徴はNR4A欠損型CAR-T細胞が疲弊化を免れて、がん細胞を長期に攻撃できる理由の一つと考えられます。
最後に、これらの結果をヒトでのがん治療に応用するために、ヒトの肺がん細胞を移植した超免疫不全マウスにNR4A欠損型のヒトCAR-T細胞を移入し、抗腫瘍作用を調べました。通常のT細胞や、野生型のCAR-T細胞を移入した超免疫不全マウスでは腫瘍細胞が盛んに増殖しマウスは死亡します。これに対し、NR4A欠損型CAR-T細胞を移入した超免疫不全マウスでは腫瘍は増殖せず、マウスの寿命を延ばすことができました(図2)。
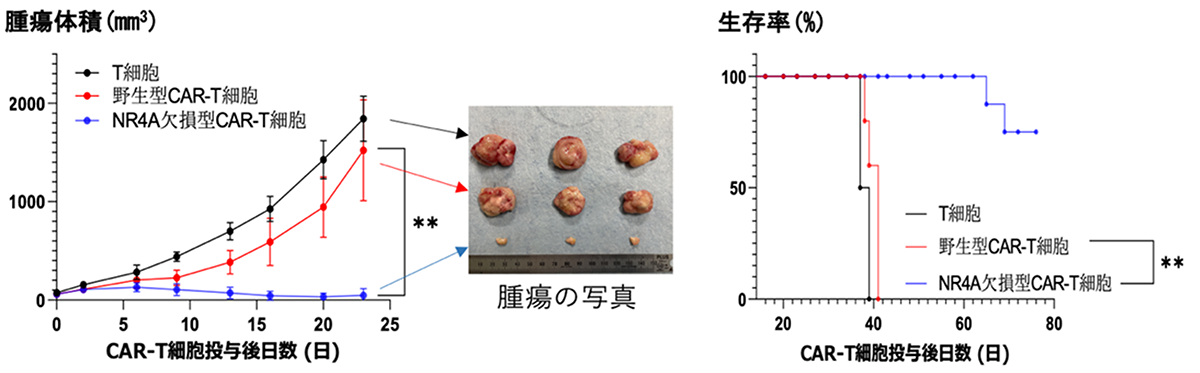
図2.NR4A欠損型CAR-T細胞は強い抗腫瘍効果を発揮する
マウスの皮下に腫瘍細胞を移植し、その後に図に示す遺伝子型のCAR-T細胞を血管内に注入した。CAR遺伝子導入をしていないT細胞や野生型のCAR-T細胞では腫瘍が大きくなったが、NR4A欠損型CAR-T細胞では抗腫瘍作用が強いため、腫瘍は成長しなかった(左)。またNR4Aの発現をなくしたCAR-T細胞は、野生型のCAR-T細胞に比べ、有意にマウスの寿命を延ばした(右)。**は有意差があることを示す。
今後の展開
今回の研究を通してNR4Aを抑制することで、CAR-T細胞療法の新しい治療戦略となるほか、がん免疫療法における新規治療薬の開発につながることが期待できます。
【用語解説】
(注1)CAR-T細胞療法
Chimeric antigen receptor-T細胞療法の略称である。CAR-T細胞は、遺伝子導入により腫瘍細胞抗原を認識する抗体部分の細胞外ドメインと、抗原受容体のシグナルを伝えるためのドメインを人工的に細胞内に持たせたT細胞である。がん患者さんの末梢血T細胞から樹立し、CAR遺伝子を導入してから患者さんの体内に戻すことによってがんを治療することをCAR-T細胞療法という。
(注2)固形がん
固形がんは、血液がん以外の、臓器や組織などで塊をつくるがんの総称である。固形がんは、各種臓器や表皮の上皮細胞から発生する上皮細胞がん(胃がん・肺がん・子宮がんなど)と骨、筋肉などから発生する非上皮細胞がん(肉腫)に分かれる。固形がんの多くは、上皮から発生する上皮細胞がんとされる。
(注3)免疫チェックポイント阻害療法
がん細胞は免疫細胞の攻撃から逃れるために、免疫応答にブレーキをかける。免疫チェックポイント分子と呼ばれるたんぱく質は、このようなブレーキの役割を果たしており、その代表的なものがPD-1やCTLA4であり、PD-1やCTLA4の機能を抗体により阻害することで腫瘍内の免疫反応を増強するのが免疫チェックポイント阻害療法である。抗PD-1抗体の代表的なものがオプジーボ®であり、発見者の本庶佑教授がノーベル医学生理学賞を受賞した。
(注4)NR4A
NR4Aは、NR4A1、NR4A2、NR4A3からなるオーファン核内受容体ファミリーのメンバーであり、転写因子として働き、T細胞の活性化を強く抑制する。マウスモデルにおける慢性免疫応答では、NR4A転写因子はNF-ATによって誘導され、AP-1/NF-kBと競合することでサイトカインの発現を抑制し、PD-1などの抑制性受容体の発現を直接促進することで、CD8+T細胞の機能不全/疲弊状態を引き起こす。よってNR4AはT細胞の疲弊に中心的な役割を果たす因子の一つと考えられている。
参考文献
- NR4A transcription factors limit CAR T cell function in solid tumours.
Chen J, López-Moyado IF, Seo H, Lio CJ, Hempleman LJ, Sekiya T, Yoshimura A,Scott-Browne JP, Rao A.
Nature. 2019 Mar;567(7749):530-534. doi:10.1038/s41586-019-0985-x. Epub 2019 Feb 27. - NR4A ablation improves mitochondrial fitness for long persistence in human CAR-T cells against solid tumors.
Nakagawara K, Ando M, Srirat T, Mise-Omata S, Hayakawa T, Ito M, Fukunaga K, Yoshimura A.
J Immunother Cancer. 2024 Aug16;12(8):e008665. doi: 10.1136/jitc-2023-008665.

左より:筆頭著者の中川原賢亮(内科学教室(呼吸器)助教)、責任著者の吉村昭彦(微生物学・免疫学教室(研究当時)教授)

