あたらしい医療
小児科
脊髄性筋萎縮症に対する新しい治療~アンチセンス核酸医薬品と遺伝子治療~
脊髄性筋萎縮症とは
体の筋肉を動かす指令を出す運動神経細胞が変化ないしは消失することにより、主に筋肉に症状が現れる生まれつきの疾患です。早い場合には出生直後から、手足をあまり動かさない(floppy infantと呼ばれます)、呼吸とともに胸郭が凹凸するなどの症状で気づかれ、筋力が低下したり、筋肉がやせ細ったり(筋萎縮)、哺乳や食べ物の飲み込みが難しいといった症状が現れます。症状が進むと、呼吸を維持するのが難しくなり、気管切開や人工呼吸器が必要になります。重症の場合には、治療が行われなければ、数か月以内に死亡します。一方で、この疾患では一般に知能は侵されません。
原因
この疾患の患者さんのほとんどは、運動神経の生存や機能維持に必要なタンパク質を産生するSMN1遺伝子を持っていない、あるいは変化していることが原因です。SMN1遺伝子は、運動神経細胞の生存や機能維持に必要なSMNタンパクを作るために必要です。SMNタンパクが不足すると、運動神経細胞の機能を維持できなくなり、上記のような筋肉の症状を引き起こします。診察上は、打腱器で膝や肘を叩いでも手足が反応して動かない(深部腱反射の消失あるいは減弱といいます)が特徴です。
この疾患は、通常2つあるSMN1遺伝子の両方の働きが失われたときに発症します(常染色体劣性遺伝病といいます)。片方のSMN1遺伝子の機能が失われただけでは発症しません(保因者といいます)。脊髄性筋萎縮症の子供を持つ両親は通常保因者であり、この両親から、再度脊髄性筋萎縮症を持つ子供が生まれる確率は25%です。
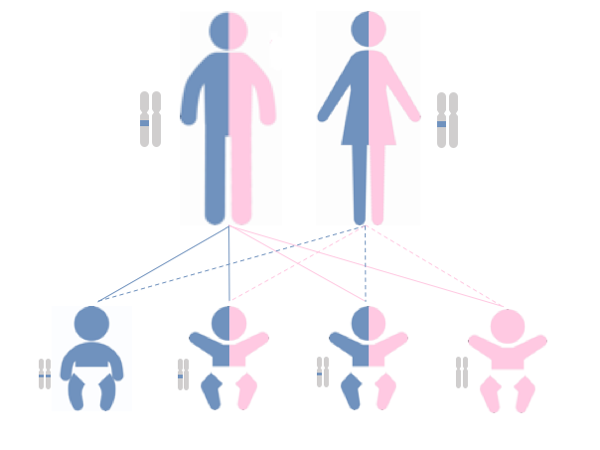
図1
常染色体劣性遺伝病では、ともに変化を持った遺伝子を受け継いだときにのみ発症する(1番左の青い児)。片方だけが変化を持つ遺伝子である場合は、発症せず、保因者という(真ん中の2人)。すなわち、保因者の両親からは、25%の確率で罹患児が出生する可能性がある。25%の確率で変化を持つ遺伝子が引き継がれない(一番右の桃色の児)。
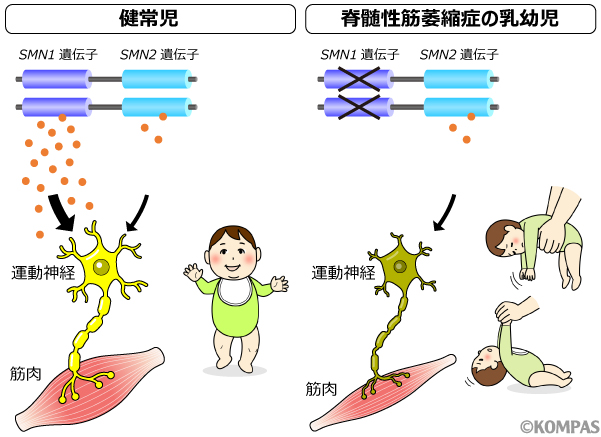
図2
左図: 健常児では、SMN1遺伝子から作られるSMNタンパク(オレンジの丸)により運動神経が発達する。
右図: 脊髄性筋萎縮症の乳幼児では、生まれつきSMN1遺伝子が欠失しているあるいは機能しないため、十分な量のSMNタンパクが作られない。そのため、運動神経が発達できず、筋力が低下する。
治療法
アンチセンス核酸医薬品:ヌシネルセン(商品名スピンラザ®)
人の体には、SMN1遺伝子とよく似た配列を持つSMN2遺伝子が存在します。健常な人では、SMN1遺伝子によって十分な量のSMNタンパクを作ることができるため、SMN2から作られるSMNタンパクは、体内ですぐに分解される機構が働いています。
ヌシネルセン(スピンラザ®)は、SMN2遺伝子の転写産物の特定の部位に結合するように設計された核酸(アンチセンス核酸といいます)です。この特殊な核酸により、SMN2遺伝子から作られるSMNタンパクを分解する機構を阻害することで、体内のSMNタンパクを増やす治療です。髄液注射が行われ、数か月おきに定期的に治療を繰り返すことが必要です。2017年から日本でも保険診療として行われています。
- SMN1遺伝子の欠失又は変異を有していることに加えて、SMN2遺伝子の数の確認が必要です。
遺伝子治療:オナセムノゲンアベパルボベクゾル(商品名:ゾルゲンスマ®)
人工的に作成したSMN遺伝子を外部から患者さんの体内に導入し、不足しているSMNタンパクを患者さん自身が安定して作ることができるようにする治療法です。SMN遺伝子を治療用ベクター(治療のために設計された遺伝子の運搬体で、アデノ随伴ウイルス9型:AAV9と呼ばれます)という病原性のない殻の中に入れて、目的の運動神経細胞まで届けられるように設計されています。
AAV9によって運動神経細胞に導入されたSMN遺伝子は、神経細胞内に留まります。これにより、患者さん自身の細胞が、半永久的にSMNタンパクを作れるようになります。なお、導入されたSMN遺伝子は、もともと患者さんが持っている染色体からは離れて留まるため、患者さんがもともと持っている体質に影響を与える可能性は低いと考えられています。2020年5月から、日本でも保険診療として行われています。ゾルゲンスマの治療は、1回の点滴で治療が完結しますが、以下の点に注意する必要があります。
- 患者さんを強制的にAAV9に感染させる必要があります。一定期間(2か月程度)、副腎皮質ステロイドを内服していただき、免疫抑制状態にする必要があります。
- AAV9には病原性や増殖性がなく、ヒトを含めた生物に悪影響を与える可能性は極めて低いことが分かっていますが、患者さんの体液(鼻水、よだれ、涙)や排泄物(嘔吐物、尿、糞便)には、1か月程度はAAV9が排出されますので、その間、AAV9の拡散を最小限にするための対策が必要となります。
- 投与時に2歳未満の患者さんのみが治療対象となります。
- 事前の検査で抗AAV9抗体を持っている患者さんには投与ができません。
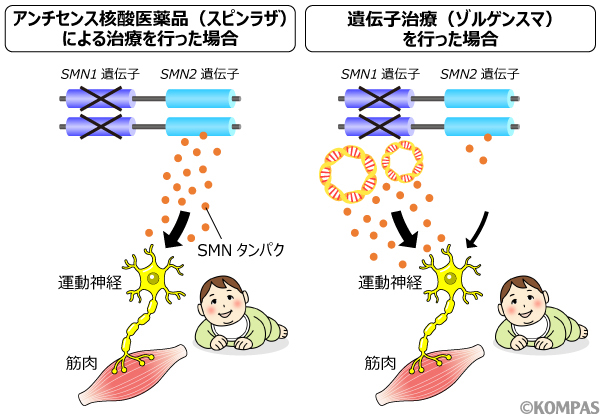
図3
左:アンチセンス核酸医薬品(スピンラザ)は、SMN2遺伝子によって作られるSMNタンパクを増やすことで運動神経の発達を促進する。
右:遺伝子治療(ゾルゲンスマ)は、体外から導入したSMN遺伝子(黄色とオレンジの輪)により体内で持続的にSMNタンパクを作れるようにすることで、運動神経の発達を促進する。
治療効果
いずれの治療法も、治療開始の年齢が早いほど効果が大きいことが報告されています。また、いずれの治療法も永続的な人工呼吸が導入されている等、すでに疾患が進行している患者さんへの有効性、安全性は確立していませんので、投与については慎重に判断する必要があります。

左から:田口寛子(臨床遺伝学センター助教)、高橋孝雄(小児科教授)、筆者 (小児科専任講師)

