病気を知る
クローン病
概要
クローン病は大腸や小腸などの消化管に炎症や潰瘍を引き起こし、下痢、腹痛などの腹部症状を来す病気です。はっきりとした原因は不明ですが、遺伝的な要因や食事や腸内細菌などの環境的な要因を背景に免疫機能の過剰・異常が生じ、病気が発症・持続するものと考えられています。環境因子では脂質や糖質の過剰摂取との関連が指摘されており、我が国の研究でも脂肪や糖質を多く含むファスト・フードとの関連が知られています。また喫煙も病気の発病や病状悪化のリスクとなることが知られており、患者さんには禁煙をすすめています。
クローン病の患者数は年々増加しており、厚生労働省難治性炎症性腸管障害に関する調査研究班が2014年に行った調査では約7万人の患者さんがいると推定されています。慶應義塾大学病院では2021年現在約700名の患者さんが定期的に通院しています。日本では男性患者さんの割合が多く、当院通院中の患者さんでは男女比が2:1になっています。発症年齢は10代後半から30代前半、20代に好発することが指摘されています。
通常は小腸と大腸が侵されることが多く、小腸型、小腸大腸型、大腸型の3型に分類されます。欧米のクローン病患者さんに比べて日本の患者さんは大腸型が少ないことが知られていますが、これは小腸病変を検索するための検査法が日本の方が施行しやすく、小腸の病変を検出できることが多いためであると考えられています。当院では小腸大腸型が多く、大腸型は約10%です。
クローン病は厚生労働省により難病に指定されているため、非常に深刻な病気という印象をもたれるかもしれません。特に腸管の狭窄、膿瘍(お腹の中に膿がたまること)、瘻孔(腸の炎症が進行して腸管と腸管、あるいは腸管と他の臓器との間に管状の欠損ができること)などの合併症を来すことも多く、病気になってから10年以内に半数以上の患者さんが1回は手術を必要とします。しかしクローン病は腸管が狭窄や瘻孔などを形成する前に治療介入することにより将来的な入院や手術になるリスクを下げることが可能であり、よくなった状態を維持(寛解維持)できれば、日々の生活にあたっては大きな制限を受けることなく、一般の方と同じライフスタイルを送ることが可能です。
症状
臨床症状としては、下痢・腹痛といった腹部の消化器症状が中心ですが、発熱や体重減少などの全身症状が主な訴えであることも少なくありません。また肛門病変である痔ろうや肛門周囲膿瘍が初発症状であることも多く、約1/3の患者さんは肛門病変が最初に生じるとされています。したがって若年者でこれらの病変をみた場合、クローン病を念頭に置く必要性があります。
また口内炎、関節炎、皮膚症状(結節性紅班、壊疽性膿皮症)、眼症状(虹彩炎)などの腸管以外の臓器に合併症(腸管外合併症)を生じることもあります。
診断
- 血液検査
血液検査では炎症(CRP、赤血球沈降速度(血沈)、白血球数)、貧血(ヘモグロビン値(Hb)、赤血球数)、栄養状態(総タンパク、アルブミン、総コレステロール値)、薬剤の副作用(肝機能・腎機能・膵酵素など)を把握することが可能です。ただしクローン病では炎症が軽度の場合にはCRPが上昇しないことも多いため、他の検査や症状などと合わせて総合的に判断します。最近では、腸管の炎症を示す新しい血液検査項目として血中ロイシンリッチα2グリコプロテイン(LRG)が測定可能となりました(ただし保険適応上、次の検査まで3か月以上あける必要があります)。従来のCRPと組み合わせることによって、CRPが上がりにくい患者さんにおける状態評価に有効な場合があります。 - 便検査
クローン病では、見た目に正常な便であっても少量の血液が混じっていることがあります。便潜血検査は便中の微量の血液を検出する検査で、本来大腸がん検診で使用されるものですが、ある程度大腸の炎症とも相関するため寛解の確認に有用です。便中カルプロテクチンの測定は腸管粘膜の炎症を評価することができますが、国内ではクローン病の病勢評価に対しては保険適応外であるため、当該検査の活用は診断時に限定されます。便検査は、内視鏡検査と比較して寛解の判定において補助的な位置づけではあるものの、体の負担が少ない点で有用です。 - 大腸内視鏡検査・バルーン小腸内視鏡
内視鏡検査は、消化管粘膜の炎症を直接確認することで、炎症の程度や範囲を診断するうえで最も重要です。定期的な検査により病気の状態を評価することができるほか、クローン病の診断をするうえでも必要不可欠な検査です。通常の大腸内視鏡検査では小腸の一部しか観察ができないため、最近は小腸の深部まで観察可能なバルーン小腸内視鏡検査が開発され、大腸と小腸(大腸内視鏡よりも広範に小腸の観察が可能)を同時に観察することができます。
必要に応じて生検(顕微鏡で調べるために、病変の一部の組織を切り取ること)を行うこともあります。生検による組織検査は診断基準の1つに挙げられているので、初回の診断時には必要な検査となります。また治療により症状が改善されていても粘膜の炎症が改善されていない場合も多いため、炎症が消失していることを内視鏡で確認することもあります(図1)。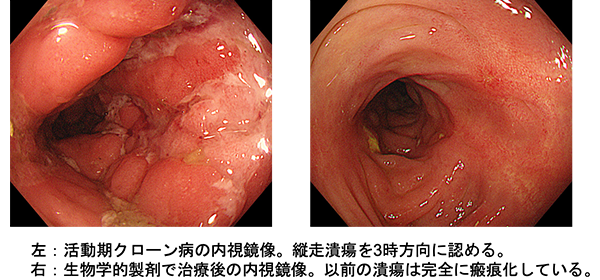
図1.治療前後の大腸内視鏡像
- 小腸造影検査
小腸病変の有無を確認するために口から造影剤を飲んでもらい体位変換を繰り返し、造影剤を腸管に流して観察する方法です。場合によっては鼻から細いチューブを入れてチューブより造影することもありますが、当院では原則としてチューブを入れずに検査しています。瘻孔や狭窄を観察するには必要な検査です。 - カプセル内視鏡
患者さんに小型カメラを内蔵したカプセル状の内視鏡を飲み込んでもらい、消化管を通過しながら画像を撮影し、記録装置に転送することによりクローン病の小腸病変を確認する方法です。腸管を洗浄するための下剤服用の必要がなく、検査による苦痛がないことは利点ですが、狭窄がある場合にカプセルが滞留(腸管に留まってしまい肛門から排出されなくなってしまうこと)する危険があるので、あらかじめ撮影用のカプセル内視鏡と同じ大きさで長時間腸に留まっていると溶けるカプセル(パテンシーカプセル)を服用してもらい、カプセルが通過するのを確認してから実際のカプセル検査を施行しています。(図2) - MRエンテログラフィー
大腸内視鏡の前処置で使用する下剤を用いて腸管を伸展させてから、MRI撮影を行うことにより粘膜炎症や潰瘍病変、狭窄、瘻孔病変を評価する検査方法です。小腸造影検査のような放射線被曝がない検査法であり、当院では積極的にMRエンテログラフィーによる検査をクローン患者さんに取りいれています(図2)。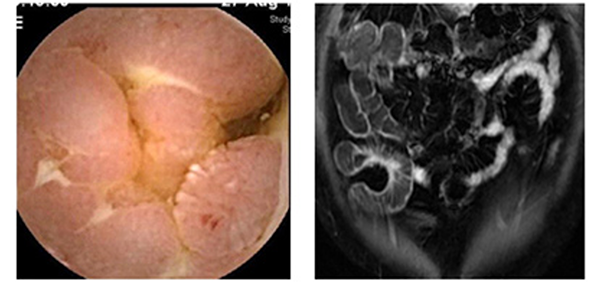
図2.カプセル内視鏡(左)とMRエンテログラフィー(右)
治療
- はじめに
クローン病の治療目標は、早期の寛解導入と長期の寛解維持を実現することにより、瘻孔や狭窄などの腸管合併症を防ぎ生活の質を維持することにあります。そのため活動期には寛解導入療法(炎症を鎮静化するための治療)を行い、寛解導入ができた後は引き続き寛解維持療法(良くなった状態を維持し、再燃を抑制するための治療)を継続していくことが原則となります。かつては、症状がない状態(臨床的寛解)が治療の目標と位置付けられていましたが、そのような状態でも内視鏡検査やMRIなどの画像検査を行うと炎症が残っていることもしばしばあり、気が付かないうちに瘻孔や狭窄といった腸に不可逆的なダメージが起こってしまうこともあるため、近年では内視鏡検査をはじめとした画像検査においても炎症がない状態を達成することが重要と考えられています。実際には、臨床症状や内視鏡検査所見などをもとに重症度を判断し、各々に見合った治療薬を選択します。厚生労働省難病研究班の治療指針を簡略化したものを図3に示します。
寛解導入療法後に自覚症状が改善したため治療を中断されてしまう患者さんも中にはいらっしゃいますが、クローン病は再燃することも多くあるため、症状のない寛解期にもしっかりと治療を続けていくことが大切です。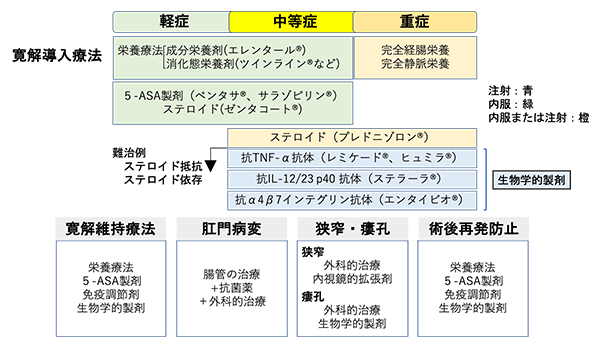
図3.クローン病の内科治療
- 栄養療法
厚生労働省の治療指針において基本治療として挙げられています。栄養療法はクローン病の寛解導入・寛解維持の双方に効果を示す治療法です。腸管の安静ならびに腸からの食餌抗原(特定されてはいませんが、食物の中にあり腸を刺激し炎症を起こすと考えられる物質)の除去を図ります。経口/経管栄養(栄養剤を飲む/鼻から入れたチューブを通して胃に入れる)と完全静脈栄養(すべての栄養を太い静脈に入れた点滴から入れる)の2種類があります。腸閉塞、腹腔内膿瘍、重篤な肛門病変、大量出血など腸を安静にしなければいけないときは完全静脈栄養が選択されますが、その他の例では成分栄養剤であるエレンタール®を用いた経口/経管栄養療法が行われます。最近ではライフスタイルの変化やエレンタール®のフレーバーやボトルの改良などが進み経口で2-3包/日を摂取している患者さんも多くいらっしゃいます。 - 薬物療法
- 5-ASA製剤・ステロイド・抗菌薬
まずは、5-ASA製剤が投与されます。栄養療法や5-ASA製剤にて寛解導入できない症例にはステロイドの投与を検討しますが、大腸病変が主体の症例や重症例では早期から副腎皮質ステロイド併用を考慮します。また肛門病変合併例にはフラジール®またはシプロキサン®などの抗菌薬を使用します。 - 免疫調節剤
すぐに再び病状が悪化する症例やステロイド離脱困難例では、寛解維持を目的に少量の免疫調節剤(ロイケリン®またはアザニン®)の使用を検討します。免疫調節剤の副作用として、開始後早期に出現する白血球減少と全脱毛が挙げられ、アジア人においてはNUDT15遺伝子多型(ヒトの中で比較的多く認められる遺伝子の個体差を遺伝子多型といいます)と症状が関連することが判明しています。当院では副作用を予期・回避するために治療開始前にNUDT15遺伝子多型検査を行っております。また薬剤使用中は、副作用が出現していないかのスクリーニングを定期的に行っております。 - 生物学的製剤
ここまでの治療で十分な効果が得られない中等症~重症の症例を有する患者さんに対して、抗TNF-α抗体製剤であるレミケード®の点滴投与やヒュミラ®の皮下注射投与を使用します。いずれも使用した約70%の患者さんに対して治療効果が比較的速やかにみられます。副作用として投与時のアレルギー反応のほか、特に結核や真菌に対する免疫能の低下が挙げられますが、当院では副作用で中止する患者さんの数はこれまで非常に少数です。ヒュミラ®は皮下注射で用いられ自己注射も可能です。看護師による自己注射の指導がありますのでご安心ください。レミケード®とヒュミラ®の臨床試験での成績はほぼ同等と考えられており、アレルギー反応の有無や生活スタイルに合わせて選択することが可能です。
また近年ではレミケード®やヒュミラ®とは違う作用機序の生物学的製剤である抗インターロイキン12/23抗体製剤(ステラーラ®皮下注射)、抗α4β7インテグリン抗体製剤(エンタイビオ®点滴静注)も使用可能となっています。投与方法(点滴・皮下注射)と投与間隔を簡略化したものを図4に、当院での2020年の使用状況を図5に示します。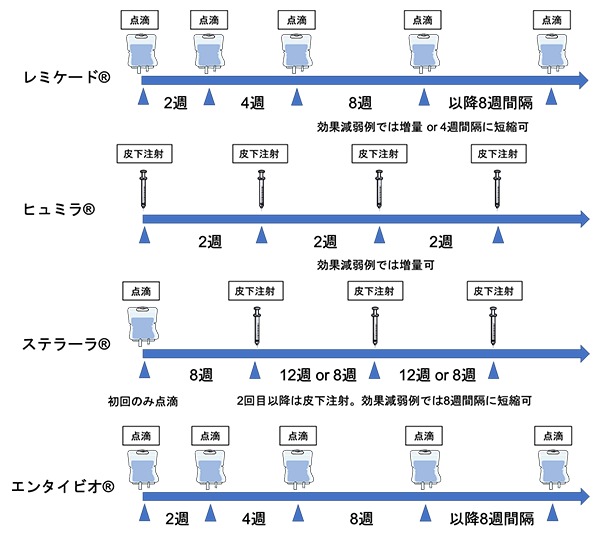
図4.生物学的製剤の投与方法
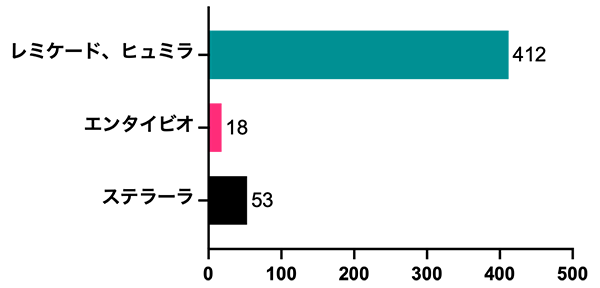
図5.当院での生物学的製剤の使用人数(2020年)
その他の治療として、血球成分吸着・除去療法も大腸病変を有するクローン病に使用可能です。薬物療法と併用で使用されています。
各種治療法のどれを選択すべきかについては、重症度やこれまでの治療歴、個人のライフスタイル等とその治療薬の特性を考慮しながら経験豊富な専門医が検討を行います。
- 5-ASA製剤・ステロイド・抗菌薬
- 外科的治療・内視鏡下狭窄拡張術
腸の穿孔、生命にかかわる重篤な出血、内科治療で改善しない膿瘍形成、がんの合併などは手術が必要です。難治性の腸管狭窄、腸や他臓器との瘻孔形成、痔ろう・肛門周囲膿瘍に対しては必要に応じて手術が考慮されます。腸閉塞を来した腸管狭窄は手術適応ですが、炎症の強い時期には腸管のむくみが狭窄の原因となっている場合があり、栄養療法や薬物療法により炎症が収まると狭窄が軽くなることもあります。また最近では内視鏡を用いたバルーン拡張術(風船を膨らまして腸の狭い部分を広げる)も積極的に試みています(図6)。手術を行う際には、術後の癒着の軽減や患者さんのQOL(生活の質)を考慮し、可能な限り腹腔鏡下手術を選択し腸管の切除範囲が最小限となるよう狭窄形成術を併用しています。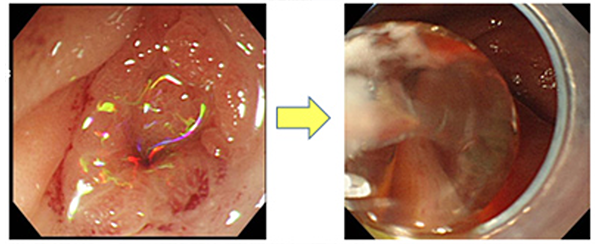
図6.狭窄病変に対する内視鏡的バルーン拡張
生活上の注意
食事については、一般的に、暴飲暴食や刺激物(大量の香辛料など)、消化の悪いものや脂っこいもの、アルコール類などは控えます。腸に狭窄のある患者さんは、きのこ・根菜類・こんにゃくなどの食物繊維の豊富な食材を食べると腹痛や腸閉塞など狭窄症状を起こす場合があるので注意してください。食事の一般事項については本記事の「栄養療法」、および潰瘍性大腸炎「生活上の注意」の項目を参照してください。
その他、運動・睡眠、解熱鎮痛剤、感染症対策、妊娠・出産については潰瘍性大腸炎の項目を参照してください。
慶應義塾大学病院での取り組み
難治の患者さんのために多くの治験や臨床試験を行っています。
当院ではクローン病に対する新しい治療法(治験)を積極的に行っています。また我々が独自に開発し、従来の治療法と異なる機序を有する治療薬の治験にも取り組んでいます。詳細は消化器内科ホームページ![]() をご参照ください。
をご参照ください。
妊娠・出産を希望される患者さんへ
当院はクローン病で治療を継続しながら妊娠・出産された患者さんを多く経験しており積極的に取り組んでいます。妊娠・分娩に関する不安・疑問点などがありましたら主治医・医療スタッフにご相談ください。

