病気を知る
造血幹細胞移植
概要
1957年に世界初の同種骨髄移植が実施されて以来、様々な改善により造血幹細胞移植は急速に進歩しており、その治療成績は格段に向上しています。現在では骨髄移植に加え、末梢血幹細胞移植、臍帯血移植も可能となり、造血幹細胞源(ソース)も多様化しています。これらを総称して「造血幹細胞移植」と呼びます。このように変化が目まぐるしい領域である造血幹細胞移植の基本的な内容と最近の進歩や問題点についてご説明いたします。
造血幹細胞移植の種類
造血幹細胞移植は大きく2つに分けることができます。自家造血幹細胞移植および同種造血幹細胞移植です。
表1.造血幹細胞移植
| 自家造血幹細胞移植 | 骨髄移植 末梢血幹細胞移植 |
|---|---|
| 同種造血幹細胞移植 | 骨髄移植(血縁、非血縁) 末梢血幹細胞移植(血縁、非血縁) 臍帯血移植(非血縁) |
- 自家造血幹細胞移植
自家造血幹細胞移植は悪性リンパ腫、多発性骨髄腫、一部の白血病の患者さんに限って行われる治療です。治療の流れを図1に示します。ご自分の細胞をあらかじめ保存(特殊な冷凍庫に凍結)しておいて、大量の抗がん剤投与(時に全身放射線照射と併用)の後に移植します。この大量の抗がん剤投与により患者さんの正常造血および悪性の細胞(腫瘍細胞)がゼロになることを目標とします。自身の細胞を移植するため、拒絶反応や特殊な免疫反応は起こらず、造血幹細胞を移植する目的は大量抗がん剤投与(注:病状によって全身放射線照射を併用することもあり、この一連の治療を移植前処置あるいは単に前処置と呼びます)によって生じる高度な骨髄のダメージから速やかに回復させるためのものです。したがって、自家造血幹細胞移植は通常の抗がん剤治療の強度を強めていく延長線上に位置づけられる治療法です。ただし、移植した細胞が働き出すまで1~2週間ほどは白血球の極めて少ない時期が続き、感染症にかかりやすく、また大量の抗がん剤投与による副作用として口や喉を含むあらゆる消化管の粘膜、肝臓、腎臓、心臓などに障害が発生します。これらは時に生命を脅かす合併症に至る可能性があります。
自家造血幹細胞移植には骨髄移植と末梢血幹細胞移植があります。しかし、骨髄を採取保存するためには全身麻酔を行うなどの体への負担が大きいことから、現在、自家骨髄移植はほとんど行われず、末梢血幹細胞移植が大部分になっています。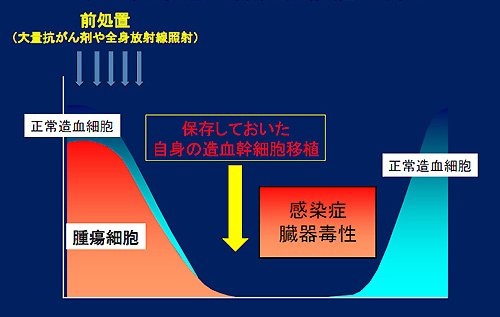
図1.自家造血幹細胞移植の流れ
- 同種造血幹細胞移植
自分以外の健康な方(ドナー)から造血幹細胞の提供を受けて移植する同種造血細胞移植には骨髄移植、末梢血幹細胞移植、臍帯血移植の3つがあります(表1)。同種造血幹細胞移植のドナーは原則としてヒト白血球抗原(HLAと呼びます)が一致している兄弟姉妹、その他の家族あるいは非血縁者です。HLAが完全に一致していることが理想的ですが、HLAの一部であれば一致していないドナーから移植をすることも可能です。また、特殊な免疫抑制療法を行うことにより、HLAが半分しか一致していない血縁者からの移植も可能となってきました(HLA半合致移植)。どの移植方法であっても治療の流れは基本的に同じとなります(図2)。まず大量の抗がん剤投与や全身放射線照射(=前処置)を行い、これが患者さんの体内の正常な骨髄(造血)細胞と悪性の細胞(腫瘍細胞)を限りなくゼロになるような強力な治療となります。この後にドナーから提供された造血幹細胞を移植します。正常造血機能が回復するには自家造血幹細胞移植より長い期間(移植後2~3週間程度)を要するため、この時期は重篤な感染症が起こりやすい危険な時期となります。また前処置という強力な治療の影響で様々な臓器(消化管、肝臓、腎臓、心臓など)にダメージが出現して、そのダメージによる合併症が生命を脅かすこともあります。ドナーの造血幹細胞が患者さんの体内で働き出すと、白血球を含めた全ての血液細胞が作られるようになります。しかし、これらの血液細胞はドナーの細胞のため、患者さんの様々な臓器を攻撃する免疫反応を起こす可能性があります。この反応は移植片対宿主病(GVHD)と呼ばれ、主にT細胞(あるいはTリンパ球)と呼ばれる細胞により引き起こされます。この反応は強く起きると命に関わるため、それを予防するための免疫抑制剤を移植後には投与しますが、完全に予防することはできません。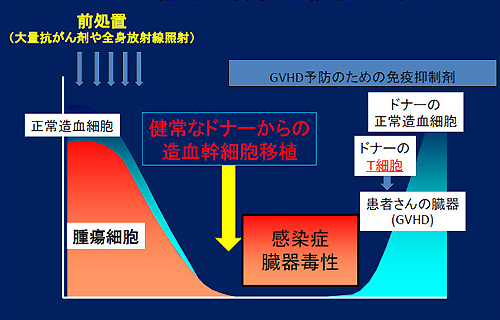
図2.同種造血幹細胞移植の流れ
以下に異なる3つの同種造血幹細胞移植の特徴を紹介いたします。
- 骨髄移植
骨髄移植のためにはドナーから骨髄を採取します。骨髄採取術は全身麻酔下で両側後腸骨より数十回の穿刺により行われ(図3)、3~4日間の入院が必要となります。現在でも我が国の造血幹細胞移植の主流となっています。これまでに骨髄採取に関連したドナーの死亡事故が全世界で4件報告されています。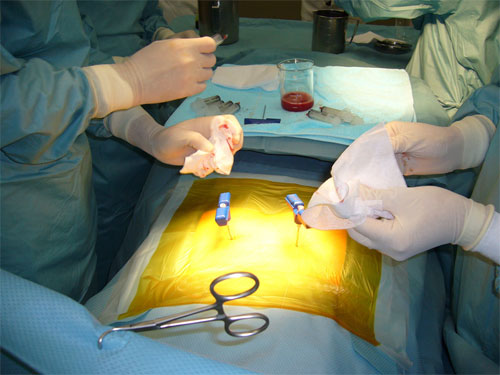
図3.骨髄採取術の様子
- 末梢血幹細胞移植
造血幹細胞は通常の状態では末梢血には存在しないために、末梢血から造血幹細胞採取を行うためには骨髄から末梢血に造血幹細胞を動員する必要があります。同種造血幹細胞移植では健常なドナーにG-CSFを連日投与4~6日後に期間限定的に幹細胞が末梢血に動員されるため、この時期に採取します。末梢血幹細胞採取は持続血液成分分離装置を用いて数時間かけて行われますが、全身麻酔などは必要なく、リクライニングチェアに横たわった姿勢で行われます。採取した細胞は冷凍庫に凍結保存され、移植する直前に解凍して使用します。末梢血幹細胞採取の最大の問題は、ある一定頻度で末梢血に幹細胞が動員されない場合があることです。末梢血幹細胞採取では血栓症のリスクが高まるといわれており、高血圧、糖尿病、高脂血症といった血栓症のリスクのあるドナーでは骨髄採取を選択する方が良いと考えられます。また骨髄採取と同様に末梢血幹細胞採取に関連した予測不能な合併症により死亡されたドナーの報告もあります。従来、骨髄バンクドナーからは骨髄採取のみが実施可能でしたが、現在は末梢血幹細胞移植も選択できるようになっています。 - 臍帯血移植
臍帯血は赤ちゃんの分娩後、臍帯(へその緒)にカテーテルを穿刺して、採取されます。前述の骨髄や末梢血幹細胞と異なり、母体にも赤ちゃんにも負担がないのが特徴です。当初、臍帯血移植は小児に対する移植が主流でしたが、現在では大人へも広く行われるようになっています。ただし体重1kgあたりに必要な細胞数が決まっており、あまり体重の大きな方では適切な臍帯血が得られない可能性があります。臍帯血移植ではHLAの型が複数違っていても移植可能なため、HLAの一致したドナーが兄弟姉妹、骨髄バンクドナーでも見つけられない場合にとても有用です。またすでに凍結保存されているため、病状から急いで移植しないといけない場合にも有用な造血幹細胞ソースです。ただし、白血球や血小板の回復が遅いことや、移植した細胞が働かない現象(生着不全と呼びます)が骨髄や末梢血幹細胞移植よりも多いことが報告されており、それを予防するための様々な検査が実施され対策がとられています。
移植前処置
前述のように同種造血幹細胞移植前に患者さんの体内にある正常な造血細胞および悪性の腫瘍細胞(白血病細胞など)を駆逐することを目的に大量の抗がん剤投与や全身放射線照射が行われます。この治療を(移植)前処置と呼びます。再生不良性貧血などの非腫瘍性疾患では患者さんの造血細胞および他人の細胞を攻撃(拒絶)する免疫系の細胞を破壊することを目的としています。選択する薬剤の種類や量、全身放射線照射を使用するかしないかなどは疾患の種類や状態、患者さんの年齢やこれまでに受けてきた治療などによって変わってきます。同種造血幹細胞移植の最も標準的な移植前処置は全身放射線照射に1あるいは2種類の抗がん剤投与を併用するものです。この前処置を骨髄破壊的前処置と呼びます。この治療は非常に強力なため、様々な臓器にダメージが現れます。具体的には粘膜障害としてひどい口内炎や下痢、肝機能異常、腎機能障害、肺や心臓の障害などが出現し、時には生命を脅かします。そのため、比較的若く、これらの臓器の機能が保たれている患者さんでなければこの治療に耐えられません。年齢の高い患者さんや臓器障害をすでにお持ちの患者さんに対しては移植前処置の強度を下げた強度減弱前処置を用いて造血幹細胞移植を行うことを検討します。この強度減弱前処置は骨髄破壊的前処置で使用する抗がん剤や全身放射線の量を減らしたり、副作用の弱い薬剤を使用したりします。ただし、強度を下げた前処置では腫瘍細胞(白血病細胞など)に対する抗腫瘍効果も低下するため、移植後の原疾患の再発が多くなる可能性があり、前処置の可否や方法は慎重に検討する必要があります。
造血幹細胞移植の副作用
- 移植片対宿主病(GVHD)
移植片対宿主病(GVHD: Graft-Versus-Host Disease)は移植したドナーの細胞が患者さんの身体(各種臓器)を攻撃する免疫反応です。そのため、自身の造血幹細胞を移植する自家移植ではみられない反応です。同種造血幹細胞移植では基本的にはHLA(白血球の型)が一致したドナーから造血幹細胞の提供を受けますが、兄弟姉妹であれ、骨髄バンクドナーであれ、移植前に実施されるHLA検査では分からない患者さんとドナーの様々な違いをドナーの細胞が認識することである一定頻度で移植片対宿主病が発症します。移植片対宿主病を起こすドナーの細胞は主にT細胞(あるいはTリンパ球)と呼ばれる細胞です(図2、図4)。T細胞は普段は私たちの体内で微生物(ウイルスなど)のような外敵を認識して排除する重要な働きをしていますが、移植によってこのT細胞がドナーとは異なる患者さんの臓器を排除するように攻撃してしまうことになるわけです。
図4.移植片対腫瘍効果
移植片対宿主病には急性型と慢性型があります(表2)。急性型と慢性型はその発症時期により分類されます。移植片対宿主病により障害される臓器は皮膚、消化管、肝臓はそれぞれに共通で、慢性型ではそれに加え、目、口、肺、筋肉・筋膜など多くの臓器が標的となります。この分類はこれまで広く使用されてきましたが、実際の患者さんでは急性型と慢性型が合併する場合や急性型が移植後3か月以降に、あるいは慢性型が移植後3か月以内に発症することもあります。そのため、この従来の分類の限界を解消するために、より細かな分類が使用されています。
表2.従来の移植片対宿主病(GVHD)の分類
発症時期* 主に障害される臓器 急性 移植後3か月以内 皮膚、消化管、肝臓 慢性 移植後3か月以降 皮膚、消化管、肝臓
目、口、肺、筋肉等*3か月はあくまで目安で、それぞれ異なる時期に発症することもあります。
移植片対宿主病は予防が重要であり、ドナーのT細胞による攻撃反応を抑えるために移植後しばらくの間は免疫抑制剤を投与する必要があります。もし移植片対宿主病を発症した場合にはさらに免疫反応を抑制するために薬剤の投与量を増やしたり、別の薬剤(ステロイドなど)を追加投与したりします。免疫抑制剤の投与は免疫反応を抑えることで免疫力が低下して発症する感染症に加え、薬剤の副作用として腎障害、糖尿病、骨折等が起こる可能性があり、投与中はこれらの副作用に注意する必要があります。移植片対宿主病は軽症では重篤な問題になりませんが、中等症あるいは重症のものは時に生命を脅かす、後遺症(呼吸機能の低下、目や口の乾き、皮膚の色調の変化など)を残して生活の質を低下させる可能性があります。
- 移植片対腫瘍効果
前述したように同種造血幹細胞移植後にはある一定の頻度で移植片対宿主病が発症します。これは造血幹細胞と一緒に移植されたドナーのT細胞が患者の臓器を攻撃する反応です。患者さん由来である腫瘍細胞(白血病細胞など)もこの攻撃の標的になることが知られています。これを移植片対腫瘍効果といいます(図4:(注)白血病の患者さんであれば移植片対白血病効果と呼びます)。この反応は移植前処置では駆逐できなかった腫瘍細胞が移植後のドナーの細胞による免疫反応により駆逐される可能性があることを示します。この反応により移植後の原疾患の再発が減る可能性があります。ただし、この反応は腫瘍の種類やその病状によって、期待できるものとそうでないものがあります。
移植後の様々な合併症
骨髄機能を完全に置き換える造血幹細胞移植には前述した移植片対宿主病以外にも様々な合併症が起こります(表3)。造血幹細胞移植後には高度に免疫能が低下しますので、感染症の頻度が非常に高いです。感染症の原因としては細菌、真菌(カビ)、ウイルス、原虫(寄生虫)と多岐にわたります。臓器障害は主に放射線や抗がん剤などの移植前処置による副作用が最も多いですが、移植片対宿主病の予防や治療に用いられる免役抑制剤、感染症に用いる抗菌薬等によるものもあります。障害される臓器は口をはじめとした消化管粘膜、肝臓、腎臓、皮膚、心臓、肺などです。骨髄(造血)機能が回復するまでの期間はその機能が全くない状態ですので、貧血に対しては赤血球輸血、血小板減少に対しては血小板輸血が必要となります。血小板が減少すると出血しやすくなるため、紫斑(アザ)や鼻血、消化管出血や脳出血といった重篤な出血が起こることもあります。その他、移植前処置により、大部分の患者さんが精巣や卵巣が高度に障害され、永久的な不妊症となります。挙児希望があれば、移植前に男性では精子保存、女性では卵子保存が必要になります。しかし、精巣も卵巣もそれまでの治療により障害を強く受けている可能性があり、精子や卵子を保存できないことも少なくありません。また卵子保存は精子保存よりも技術的に難しいため、実施不可能と判断せざるを得ないこともあります。
また移植後には健常人に比べて発がん率が高いことが知られており、定期的な健康診断やがん検診による健康管理が必要となります。
表3.造血幹細胞移植の合併症
| 移植片対宿主病 |
| 感染症 |
| 臓器障害(粘膜、肝臓、腎臓、肺、心臓など) |
| 出血 |
| 永久不妊 |
| 発達障害 |
| 二次発がん |
原疾患の再発
これまで述べてきたように造血幹細胞移植は非常に強い治療(移植前処置)を行い、同種造血幹細胞移植では健常なドナーの細胞(T細胞)による免役反応(移植片対腫瘍効果)も期待することで、通常の治療では根治が難しい病気を治すことを目標としています。しかし、残念ながらこのような治療を行っても病気が再発してしまう患者さんがおります。その再発は移植後1~2年以内が最も多いですが、まれに移植後5年以上経過してから再発する患者さんもいます。再発率は病気の種類や移植時の病状(寛解(症状が落ち着いて安定した状態)か非寛解か)などにより大きく異なります。主な疾患の移植成績に関しては日本造血細胞移植データセンターのウェブサイト![]() で参照することができますので、そちらをご覧ください。
で参照することができますので、そちらをご覧ください。
この治療で改善できる病気
造血幹細胞移植は通常の抗がん剤治療では根治が難しいと考えられる急性および慢性白血病、骨髄異形成症候群、悪性リンパ腫、多発性骨髄腫といった悪性の血液疾患が主な対象ですが、再生不良性貧血などの悪性でない血液疾患に対しても行われています。
この治療を受けることができる患者さん
従来は50歳以下の患者さんのみが対象とされていました。しかし、現在では条件にもよりますが、それよりも高齢な患者さんに対して強度を減弱した移植前処置を用いた造血幹細胞移植が行われるようになっています。
本稿にてご説明させていただいたように造血幹細胞移植は通常の治療では 根治が難しい病気を治すことを目的として行われています。しかしながら、その治療の性質上、治療に伴う合併症が致命的になる可能性が高い治療法です。また後遺症を残すこともあります。そのため全ての患者さんが実施できるわけではなく、造血幹細胞移植の実施の可否は慎重に決定されます。また実施した場合にはかなり辛い症状を伴う時期があります。これらのことを十分に理解した上で、ご家族とよく話し合い、患者さん自身が決断しなくてはなりません。また血縁・非血縁に関わらずドナーの方にも大きな負担がかかる治療であることを忘れてはいけません。

