研究の背景
神経内科領域で扱うジスキネジアは、パーキンソン病治療薬であるL-DOPAを長期間服用することで生じます(L-DOPA誘発性ジスキネジア)。精神科領域で扱うジスキネジアは、抗精神病薬を長期間服用することで生じます(遅発性ジスキネジア)。どちらも、服薬後すぐ(当日〜数日)には起こらず、服薬を開始して数か月から数年経過してから起こります。L-DOPA誘発性ジスキネジアでは、体がクネクネと自分の意志とは無関係に動いてしまいます。遅発性ジスキネジアでは、口がモゴモゴと動いてしまいます。これらのような治療薬の長期服用後に起こる副作用の発生機序を明らかにしていくには、治療薬の既知の作用を一つ一つ追いかけていく方法が考えられますが、一つの薬理作用は数秒でみられますので、これら秒単位の薬理作用の積み重ねを1か月後まで追いかけていくのは現実的ではありません。
本研究では学習に伴う脳構造の変化に着目しました。この先行研究(文献1)では、お手玉が全くできないヒトをお手玉ができるようになるまで訓練させます。お手玉を学習するときには、何回も試行錯誤を繰り返し、最終的にできるようになります。そのステップは数え切れないほどありますが、結果だけを切り取れば、「お手玉ができるようになった」わけです。お手玉ができないときにMRI (注1)で脳構造画像を撮っておき、お手玉ができるようになった後にもMRIで画像を撮ります。期待通りに、その前後で脳構造に違いがあることが分かりました。学習過程で起こる脳内の様々な反応をすっ飛ばし、できる・できないの違いを、脳構造の違いに落とし込むのです。ヒトを用いた研究はここまでですが、モデル動物を使えばさらにミクロレベルの脳構造の違いが分かるはずです。このように、脳のかたちの変化をとらえるアプローチで、ジスキネジアの発症メカニズムの解明に挑みました。
研究の内容と結果
線条体神経細胞でのVGAT遺伝子の過剰発現がL-DOPA誘発性ジスキネジアと遅発性ジスキネジアに共通する病態だった
まず本研究グループは、体の半分だけがパーキンソン病になるマウス(半側のドパミン神経を除去したマウス)を作成しました。このマウスにL-DOPAを2週間投与すると、ジスキネジアが病気側にだけ起こります。病気側と健常側の脳構造をMRIで比較してみると、淡蒼球や黒質と呼ばれる部位がジスキネジアの発症後に、病気側で大きくなっていることが分かりました。
次に、L-DOPA誘発性ジスキネジアモデルマウスの淡蒼球や黒質が、脳内の何細胞の何という突起が大きくなることで肥大するのか、顕微鏡を用いたミクロ・ナノレベルの組織学的解析を行いました。その結果、L-DOPA誘発性ジスキネジアモデルにおいて、淡蒼球へ入力してくる神経線維(線条体神経細胞の軸索)の末端が肥大すること、淡蒼球で入力を受け取る神経細胞体が肥大することを発見しました(図1)。軸索末端の肥大は、線条体神経細胞でのVGAT遺伝子(注2)の発現増加と相関していました。さらに、この形態変化と遺伝子発現変化は、遅発性ジスキネジアでも共通していました。
ジスキネジアで起こっている病態、すなわち線条体神経細胞でのVGAT遺伝子発現増加を真似ることを目的として、野生型マウスの線条体神経細胞にVGAT遺伝子を人為的に過剰発現させる実験を行いました。その結果、線条体神経細胞の軸索末端が肥大すること、接続先の淡蒼球神経細胞体も肥大することに加えて、線条体神経細胞と淡蒼球神経細胞の神経伝達が増えることが分かりました。L-DOPA誘発性ジスキネジアモデル、遅発性ジスキネジアモデルともに、VGAT遺伝子を過剰発現させることでジスキネジアが悪化すること、VGAT遺伝子をノックダウンさせることでジスキネジアが軽減することを明らかにしました。これらの結果から、線条体神経細胞でのVGAT遺伝子の過剰発現がジスキネジア発症の共通要因であることが明確になりました。
ジスキネジア病態がある、ないという状態の違いが、脳の構造の違いに裏付けられるというアイデアから、モデルマウスを用いてマクロな解剖学、ミクロな組織学を展開し、ジスキネジアの発症に関与する遺伝子メカニズムまで解明することができた良い例です。
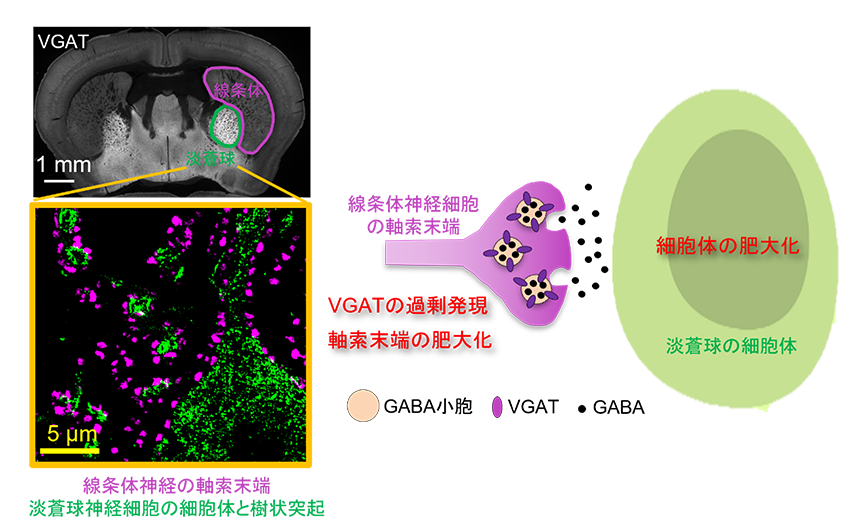
図1.2つのジスキネジアで起こっている共通の病態
なぜVGAT遺伝子の過剰発現が起こるのか
どのような条件が揃うと線条体神経細胞のVGAT発現が増え、ジスキネジアが発症するのでしょうか。研究グループは、ジスキネジア発症の「Two-Hit仮説」を立て、それを検証しました。
- L-DOPA誘発性ジスキネジアの場合(図2B):パーキンソン病によりドパミン神経が脱落し、ドパミン濃度が低下し、線条体神経細胞のドパミン受容体2型を介する信号(D2R信号)が低下します(1st hit)。これに加えて、L-DOPAの摂取による脳内ドパミン濃度の周期的な変動が加わる(2nd hit)ことでジスキネジアが発症します。
- 遅発性ジスキネジアの場合(図2C):抗精神病薬投与によりD2Rがブロックされます(1st hit)。さらに、日常の様々な刺激(ビックリする、楽しいなどの感情変化から精神的ストレスや違法薬物の使用など)によって脳内ドパミン濃度の変動が繰り返し起こり、これが2nd hitとして作用します。
本稿では仮説検証方法ならびに結果の詳細を省きますが、線条体神経細胞のD2R信号が低下している状態(1st hit)がベースにあって、脳内ドパミン濃度の変動が長く持続すること(2nd hit)が加わって、線条体神経細胞のVGATが過剰発現し、ジスキネジアの病態が発展することが明らかになりました。
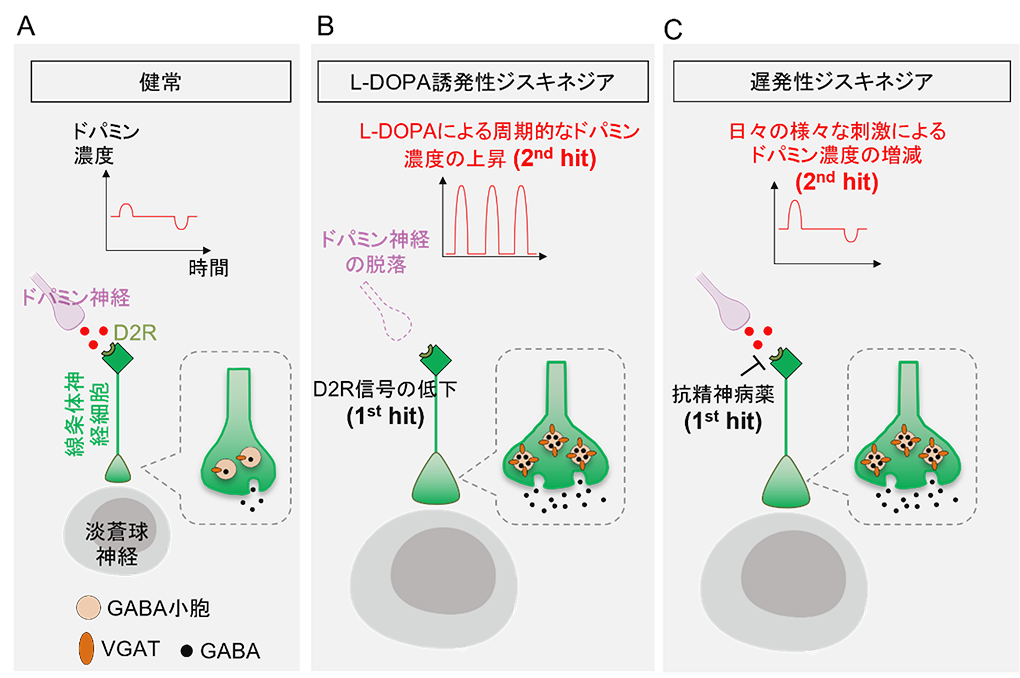
図2.ジスキネジア発症のメカニズム「Two-Hit仮説」
今後の展望
本研究によってL-DOPA誘発性ジスキネジアや遅発性ジスキネジアの共通病態として線条体神経VGATの過剰発現が発見されましたので、VGAT分子をターゲットとした新規治療法や診断方法の開発が期待されます。さらにTwo-Hit仮説は、素因(1st hit)に環境因(2nd hit)が累積して発症へと展開するモデルを提唱します。素因と環境因の相互作用は、統合失調症をはじめとする多くの慢性精神疾患に通底する発症メカニズムであると想定されていますが、具体的にどのようにそれぞれの要因が作用しているのかほとんど分かっていませんでした。今回の発症モデルは、環境因が累積して疾患が発展していく様子を上手くとらえています。精神疾患の発症過程の理解が進むことを期待しています。
【用語解説】
(注1)MRI
核磁気共鳴画像法(Magnetic Resonance Imaging)は、磁気を利用して非侵襲的に脳の断面図を得る方法である。本研究では脳構造画像と呼ばれるMRI画像から脳体積変化を可視化する技術を用いている。
(注2)VGAT遺伝子
小胞GABAトランスポーター(vesicular GABA transporter)の遺伝子である。抑制性の神経細胞である線条体神経細胞に発現しており、細胞内でつくられたGABAをGABA小胞に蓄える働きがある。蓄えられたGABAは線条体神経細胞が活性化することで、細胞外に放出され、受け手である淡蒼球神経細胞の活動を抑制する。
参考文献
- Neuroplasticity: changes in grey matter induced by training.
Draganski B, Gaser C, Busch V, Schuierer G, Bogdahn U, May A.
Nature. 2004 Jan 22;427(6972):311-2. doi: 10.1038/427311a. - Shared GABA transmission pathology in dopamine agonist- and antagonist-induced dyskinesia. Abe Y, Yagishita S, Sano H, Sugiura Y, Dantsuji M, Suzuki T, Mochizuki A, Yoshimaru D, Hata J, Matsumoto M, Taira S, Takeuchi H, Okano H, Ohno N, Suematsu M, Inoue T, Nambu A, Watanabe M, Tanaka KF.
Cell Rep Med. 2023 Oct 17;4(10):101208. doi: 10.1016/j.xcrm.2023.101208. Epub 2023 Sep 28.

左より:阿部欣史(先端医科学研究所(脳科学研究部門)学部内講師)、田中謙二(同研究所教授)、竹内啓善(精神・神経科准教授)
最終更新日:2024年2月1日
記事作成日:2024年2月1日