研究の背景 〜ヒトiPS細胞由来心筋細胞を用いた臨床応用の可能性〜
多分化能と自己複製能をもつヒト人工多能性幹細胞(ヒトiPS細胞)は、心臓自体を傷つけずに皮膚や血液から得られ、患者さんの病態の特性をもつ心筋細胞を大量に作製することが可能です。増殖することがほとんどないヒトの心筋細胞を研究目的で患者さんから直接採ることは技術的・倫理的に難しいため、このことは心疾患研究の障壁でしたが、患者さんの遺伝情報をもつiPS細胞由来の心筋細胞(ヒトiPS心筋細胞)は、創薬(新規薬剤の発明)のスクリーニング、病態の解明、薬剤の応答性評価にも応用されることが期待されています。
一方、培養皿上で作製したヒトiPS心筋細胞は分化誘導(注1)の効率が低かったり、未分化細胞や様々なタイプの細胞が混在してしまったり、細胞が未熟であったり、臨床応用するうえで課題が残ります。我々は、これまでにヒトiPS心筋細胞を重症心不全患者さんに移植して治療に役立てるという目標に向けてこうした課題に取り組んできましたが、同時に創薬研究への応用にも大きな役割を果たすことができると考えています。ヒトiPS心筋細胞を凝集して作製する3次元人工心筋組織は2次元培養に比べて成熟が進み、心筋組織における力学的・電気生理学的な性質を分かりやすくモデル化することが可能であるため、心疾患の病態解明や新規治療薬の開発等にも実際に応用され始めています。
我々は今回、ブタの心臓から抽出したコラーゲンを用いることにより、より成熟したヒト人工心筋組織を作製することに成功しましたので紹介します(図1)。
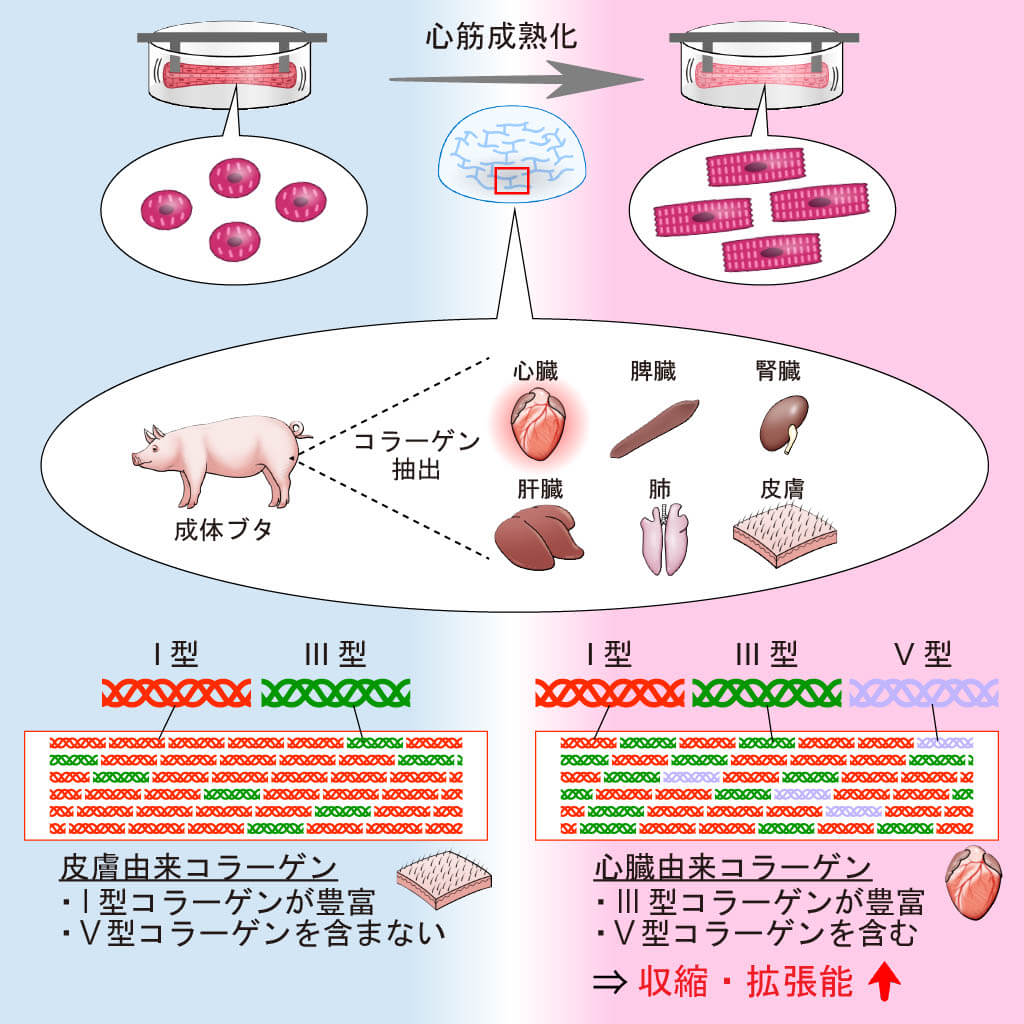
図1.心臓由来コラーゲンが人工心筋組織の成熟化を促進する
安定した組織の形状維持と収縮力の改善
人工心筋組織は2つのピラー間で収縮弛緩するミニ心筋組織であり、シリコンの鋳型内でヒトiPS心筋細胞とマトリゲル、フィブリノゲン、トロンビン、コラーゲン等の細胞外基質(注2)を混ぜて固めて作製します(図2A)。この組織は、顕微鏡で端点のピラーの動きを計測することによって、人工心筋組織の収縮の具合を評価することができます(図2B)。一般的に、臓器再生に用いるコラーゲンは、皮膚由来のものや、純化したⅠ型タイプのコラーゲンが用いられることが多いですが、我々は本研究でブタの様々な臓器(心臓、腎臓、脾臓、肝臓、肺、皮膚)からコラーゲンを抽出し、3次元心筋組織化の適正条件を検討しました。その結果、心臓由来のコラーゲンを用いたヒト心筋組織が他臓器のコラーゲンを用いた場合よりも千切れにくい組織になり、組織の形状が長期間保たれることが分かりました(図2C)。また、経時的に収縮力を比較したところ、心臓由来コラーゲンを用いたヒト心筋組織は他臓器由来コラーゲンを用いたヒト心筋組織より強い収縮力を示しました。
こうしたコラーゲンの違いの機序に迫るべくコラーゲンの線維形成能を比較したところ、心臓、腎臓、脾臓のコラーゲンは肝臓、肺、皮膚のコラーゲンと比較して線維形成アッセイで濁度が低く、細い線維を形成していることが分かりました(注3)。さらにこのような違いが生まれる原因としては、コラーゲンの組成の違いが重要であることが分かり、心臓、特にその中でも左心室に含まれるコラーゲンは他臓器と比較してⅢ型、Ⅴ型コラーゲンの比率が(Ⅰ型コラーゲンと比較して)多いことが分かりました。
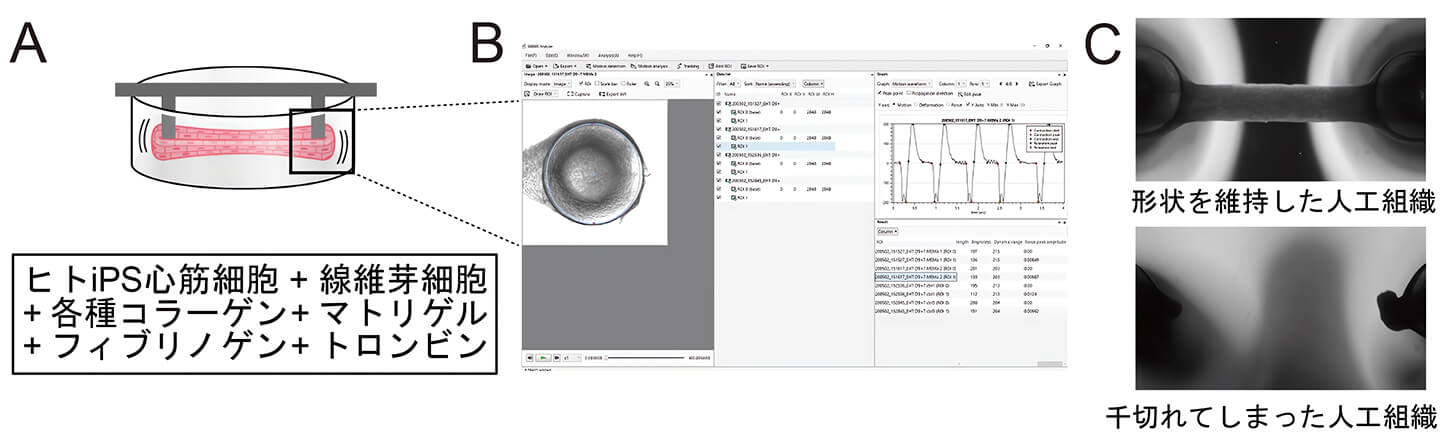
図2.人工心筋組織のイメージと解析手法
心臓由来コラーゲンによる構造的、機能的な成熟化の促進
次に、こうしたコラーゲンのプロファイルが大きく異なっていて、一般に最も再生医療の場で用いられることが多い皮膚由来コラーゲンと心臓由来コラーゲンを用いたヒト心筋組織の成熟度をコラーゲン非含有のヒト心筋組織と比較して評価しました。まずは組織の遺伝子解析において、心臓由来コラーゲンを用いることで成熟に関連する遺伝子、蛋白の発現が上昇することを確認しました。また、電子顕微鏡で心筋筋節の構造を比較すると、心臓コラーゲンの添加によりZ線、A帯、I帯、H帯の形成を伴う横紋構造の成熟化を認め、細かい筋原線維のレベルで成熟が促されていることが分かりました。フラックスアナライザー(注4)を用いた細胞代謝機能解析では、心臓コラーゲンの添加によりミトコンドリア呼吸機能が高くなり、より成熟型の代謝機能をもつことが分かりました。こうした結果から心臓由来コラーゲンは、構造的にも機能的にも成熟を促進することが示されました。
組織の成熟化にはコラーゲン型の含有比率が重要である
最後に心臓由来コラーゲンと同様にⅢ型、Ⅴ型コラーゲンの濃度を濃くした皮膚由来コラーゲンにおいてヒト心筋組織を作製し、遺伝子発現の比較を行いました。その結果、皮膚のコラーゲンにおいてもコラーゲン組成を調整することで従来の皮膚由来コラーゲンよりも成熟化が促進されることが確認できました。
一方で、コラーゲン比率を揃えても皮膚コラーゲンは心臓コラーゲンに及ばないことから、臓器ごとの特性も何らかの重要な役割をもつ可能性が示されました。
今後の展望
本研究により、ブタ心臓から抽出したコラーゲンの添加がヒト人工心筋組織の構造的、機能的な成熟化を促進することが明らかになりました。さらにはこうした成熟化の機序にはコラーゲンの線維としての特性や、コラーゲン型の含有比率が重要な役割をもつことが明らかになりました(図1)。
また今回の発見は、これまで開発してきたほかの成熟化の手法との併用も可能であり、成熟化したヒトiPS心筋組織として創薬や疾患モデルの研究に応用されることが期待されます。さらに、こうした組織・臓器の分化・成熟に関する知見は、今後他臓器の分化・成熟誘導、臓器作製研究への応用も期待されます。
【用語解説】
(注1)分化誘導
ヒトiPS細胞は、多能性幹細胞といって体内の様々な種類の細胞に変化する力をもつが、求める細胞のみを作製することを「分化誘導」という。胚発生の過程で心臓の発生初期に関与する蛋白質を組み合わせて培地に加えることで心筋細胞のみを分化誘導する。
(注2)細胞外基質
生体において細胞以外に存在する不溶性の高分子の構造体を意味する。組織の支持体となるだけでなく、細胞外環境の情報を伝えることで細胞の増殖や分化のコントロールにも関連している。コラーゲンは代表的な細胞外基質の一つで、全身の臓器に存在する。
(注3)線維形成アッセイ
生理条件下に加温することで、フリーのコラーゲンが核を形成して分子間の架橋をつくり線維を形成する様子を比較する分析手法である。一般的に核形成にかかる時間が短いと分子間架橋の量は少なく、細い繊維になり、濁度も小さくなる。
(注4)フラックスアナライザー(Agilent Technologies社)
細胞の主要なエネルギー代謝経路である解糖系やミトコンドリアによる好気呼吸の状態を、細胞に対して無侵襲に経時的に解析する。心筋組織の成熟と細胞内小器官であるミトコンドリアの機能成熟は密接に関係していることが知られている。
参考文献
Heart-derived collagen promotes maturation of engineered heart tissue.
Tani H, Kobayashi E, Yagi S, Tanaka K, Kameda-Haga K, Shibata S, Moritoki N, Takatsuna K, Moriwaki T, Sekine O, Umei TC, Morita Y, Soma Y, Kishino Y, Kanazawa H, Fujita J, Hattori S, Fukuda K, Tohyama S.
Biomaterials. 2023 Aug:299:122174. doi: 10.1016/j.biomaterials.2023.122174.

左より:遠山周吾(内科学教室(循環器)専任講師)、谷英典(同教室、心臓病未来治療学共同研究講座特任助教)、小林英司(同教室客員教授)
最終更新日:2023年12月1日
記事作成日:2023年12月1日