研究の背景
近年、大規模ながん患者集団におけるゲノム(注1)解析が次々と実施され、がんの発生・進展の基盤となるドライバー(注2)異常の全体像が明らかにされつつあります。しかしながら、このような取り組みは、希少がんに対しては十分に行われていません。希少がんの一種である成人T細胞白血病リンパ腫(Adult T-cell leukemia/lymphoma:ATL)は造血器腫瘍(血液がん)の一種ですが、国内における発症率は非常に高く、現在でも年間約1,000名がATLを発症しています(文献1)。
ATLは、ヒトT細胞白血病ウイルス1型(HTLV-1)というウイルスに感染したキャリアの一部が、50年以上の年を経て発症します。私達はATLが発症する際に重要な役割を果たす遺伝子異常について、全エキソン解析や低深度全ゲノム解析を主体とした網羅的解析を用いて明らかにしてきました(文献2,3)。しかし、構造異常(注3)やゲノム上に存在する様々な機能を有するタンパク非コード領域における異常など、ATLのゲノム全体における遺伝子異常の解明はこれまで十分にはなされていませんでした(図1A)。
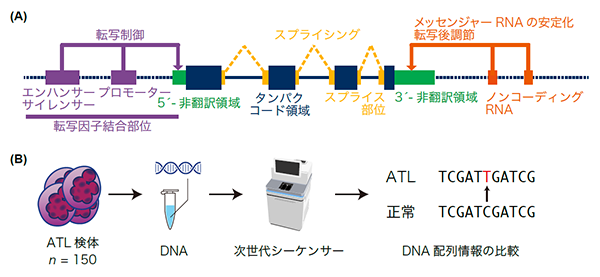
図1.全ゲノム解析の概要
(A) ゲノム上に存在する遺伝子と、遺伝子に関連する様々な機能領域の模式図。ゲノム上にはこれまで主に解析されてきた遺伝子のタンパクコード領域(紺色)の他にも様々な機能を有するタンパク非コード領域が存在しており、エンハンサー・サイレンサー・プロモーター、非翻訳領域、スプライス部位、ノンコーディングRNAなどの要素が含まれる。これらは全ゲノム解析でまとめて解析することができる。
(B) 全ゲノム解析の模式図。腫瘍細胞から抽出されたDNA(ゲノム)は次世代シーケンサーにより解析され、腫瘍が獲得した異常を同定することができる。©2016 DBCLS TogoTV / CC-BY-4.0.
研究の方法と結果
ATLにおける全ゲノム解析の実施
私達は国内外の8施設・グループから合計150例のATLの検体および正常コントロール検体を収集し、全ゲノム解析を行いました(図1B)。そのうち66例においてはRNAシーケンス解析も併用しました。腫瘍と正常検体のシーケンス深度(注4)の中央値はそれぞれ95.5×と33.7×でした。本研究は腫瘍検体におけるシーケンス深度がこれまでの全ゲノム研究より深く、異常の検出力が高いことが特徴です。これにより、タンパクコード領域および非コード領域における変異(注5)・構造異常・コピー数異常(注6)といった複数の異常タイプを横断的に解析することが可能となり、ATLのゲノム異常の全体像を明らかにすることができました(図2)。また、各異常タイプに特化したアルゴリズムを用いて解析することで、56個のドライバー遺伝子を同定しました。全ゲノム解析を用いることで、全エキソン解析が中心だった私達の以前の解析(文献2)と比較して、より多くの異常を捉えることができていました。
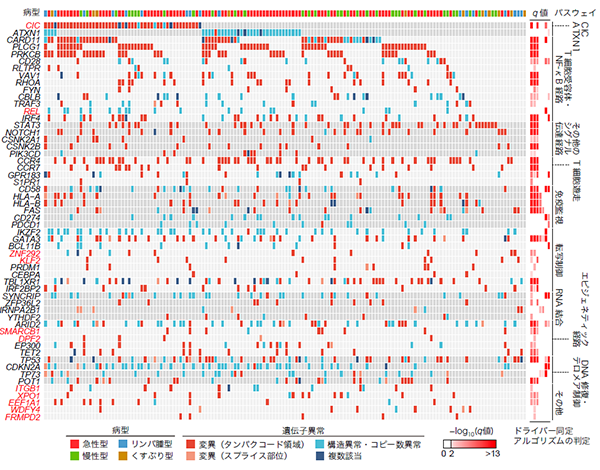
図2.全ゲノム解析によるATLの異常の全体像
縦軸はATLにおけるドライバー遺伝子(n = 56)、横軸は症例(n = 150)に対応している。ドライバー遺伝子はパスウェイごとにまとめて記載されている。
ATLにおける新規ドライバー遺伝子の同定
本研究で同定された56個のドライバー遺伝子の中には、CIC遺伝子やREL遺伝子といった、これまで報告のなかった11個の新規遺伝子が含まれていました。中でもCICにおいてはATLの33%もの患者さんで機能喪失型(注7)の異常を認めており、それらの異常はCICの長いアイソフォーム(注8)に特異的に生じていました(図3A)。このことから、(CIC-Sではなく)CIC-LがATLにおいて腫瘍抑制遺伝子として機能していることが分かりました。さらに、マウスモデルの解析により、Cic-Lの異常がT細胞の活性化や制御性T細胞(注9)の指標であるFoxp3+T細胞数の増加を引き起こすことが分かり、CIC-LはT細胞の分化・増殖を制御する上で選択的に作用していることが分かりました(図3A)。
RELにおいては遺伝子の後半が欠損する構造異常が13%のATL患者さんで生じていました(図3B)。さらに、RELの構造異常はびまん性大細胞型B細胞性リンパ腫(注10)でも高頻度に認められ、ATL以外のリンパ腫でもドライバーとなっていることが示されました。実際にこの異常を有する腫瘍では、RELの発現量が高くなり、リンパ球の増殖や活性化等を司るNF-κB経路が活性化しており、RELの構造異常がATLおよびDLBCLの発がんドライバーとして機能していることが分かりました(図3B)。
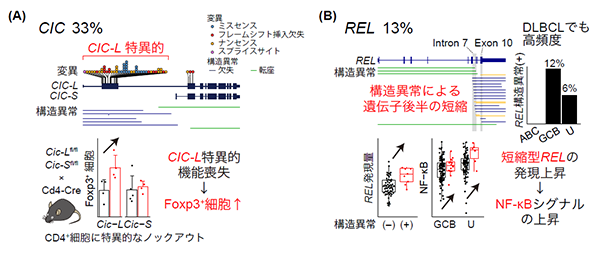
図3.新規ドライバー遺伝子の同定
(A) CIC遺伝子では、CIC-Lに特異的なエキソンに機能喪失を伴う変異・構造異常がATLの33%で観察され、CIC-Lが腫瘍抑制遺伝子として機能していることを示している(上)。また、CD4+細胞に特異的なCic-L, Cic-Sノックアウトマウス(コンディショナルノックアウトマウス)の解析により、Cic-LのみがFoxp3+細胞の増加を引き起こした(下)。
(B) REL遺伝子は遺伝子の後半を短縮する構造異常が特徴的で、ATLの13%のみならずDLBCLでも高頻度に観察された(上)。RELの構造異常は発現上昇やNF-κB経路の活性化と関連しており、これらが腫瘍発生に寄与していると考えられた(下)。ABC, GCB, UはDLBCLの亜病型。
スプライス部位における変異の集積
タンパク非コード領域における変異の集積を専用のアルゴリズムを用いて調べたところ、11箇所のタンパク非コード領域に変異が集積していることが分かりました。中でも、スプライス部位の変異を繰り返し認めました。これにはTP73, HLA-A, HLA-Bといったドライバー遺伝子が含まれ、スプライス部位の変異により実際にRNAレベルでスプライシングの異常が生じていることが分かりました。
全ゲノム解析に基づく分子分類
さらに、全ゲノム解析により明らかになったドライバー遺伝子異常パターンに基づき、ATLの患者さんを2つのグループに分子分類(注11)しました(図4A)。この2グループを比較すると、ATLの臨床サブタイプのうちリンパ腫型が特異的にグループ2に分類されていました(図4B)。さらに、グループ2はカルシウム、可溶性インターロイキン2受容体といった予後不良な臨床検査値とも関連していました(図4C)。グループ2はグループ1と比較して予後不良であり(図4D)、これは臨床病型と独立な予後因子でした。これらの結果は、全ゲノム解析に基づくATLの分子分類が、生物学的および臨床的に重要であることを示しています。
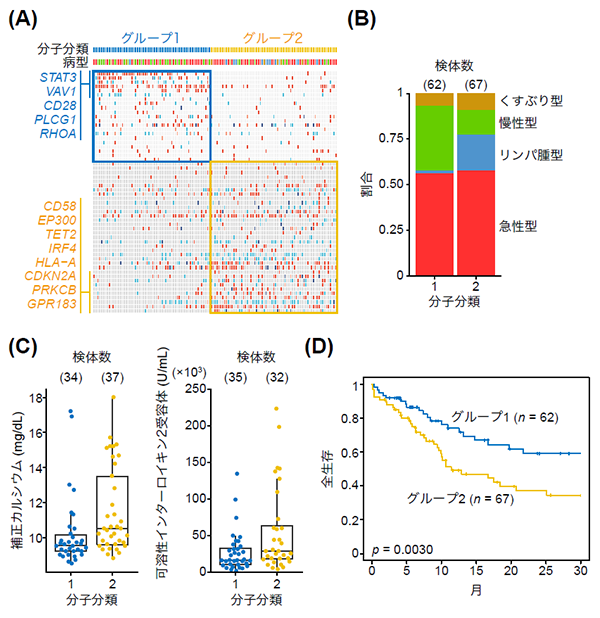
図4.全ゲノム解析に基づく分子分類の作成
(A) 全ゲノム解析の遺伝子異常情報をクラスタリングし、分子分類(グループ1および2)を作成した。それぞれのグループに特徴的な遺伝子異常がそれぞれ5個、8個同定された。
(B) 分子分類ごとのATLの臨床病型(急性型・リンパ腫型・慢性型・くすぶり型)の割合。リンパ腫型はグループ2に偏っている。
(C) 分子分類と臨床検査所見の関連。カルシウム高値や可用性インターロイキン2受容体高値は予後不良の指標として知られている。急性型のみの解析。
(D) 分子分類で層別化した全生存時間の解析により、グループ2は予後不良の指標であることが示された。
本研究の成果と意義・今後の展開
本研究は、ATLに関する初めての大規模な全ゲノム解析研究であり、ATLの遺伝学的基盤を詳細に明らかにしたものです。また、全ゲノム解析ではタンパクコード領域のみならず非コード領域を含めたがんゲノム全体にわたって多数の発見を同時に得ることができ、全ゲノム解析が今後のがん研究において不可欠であることを示しました。本研究で得られた知見は、難治性血液がんであるATLの新たな診断法や治療薬の開発につながる基盤となることが期待されます。
私達は今後もゲノム解析の技術革新を図り、さらなる発がんメカニズムの全容解明を目指します。さらにはその技術を臨床現場に応用していけるよう取り組んでまいります。
【用語解説】
(注1)ゲノム
ある生物の持つ全ての遺伝情報、あるいはそれを保持するDNAの塩基配列の全体のこと。ヒトのゲノムは約30億塩基対からなる。ゲノムはタンパクコード領域とそれ以外のタンパク非コード領域に大別されるが、それらを区別することなく全遺伝情報を解析する手法が全ゲノム解析である。大量並列シーケンサー(次世代シーケンサー)技術の進歩とスーパーコンピュータの利用により、大量の塩基配列を短時間かつ低コストで解析することが可能となった。
(注2)ドライバー遺伝子・ドライバー
異常を来すことで、がんの発生・進行などの直接的な原因となる遺伝子のこと。がん遺伝子とがん抑制遺伝子からなる。ドライバー遺伝子に生じ、がんの発生や進行に関与する異常をドライバー(ドライバー異常)と呼ぶ。
(注3)構造異常
ゲノムDNAに生じる異常のうち、長さが数十塩基対以上(典型的には数千から百万塩基対以上)のものや、染色体をまたいだ異常を指す。短い挿入・欠失や一塩基置換とは区別される。欠失、タンデム重複、逆位、転座に分類される。
(注4)シーケンス深度
ゲノム内の各塩基を平均で何回読み取ったかを示す値で、数値が高いほど変異の検出力が向上する。例えば、「全ゲノムを90×でシーケンスした」とはゲノム内の各塩基を平均90回読んだことを意味する。
(注5)変異
ゲノムDNAに生じる異常の一種で、1から十数塩基対程度の短い挿入・欠失や一塩基置換からなる。
(注6)コピー数異常
正常では2コピー(父由来・母由来)あるゲノムDNAが、1コピー以下(欠失)、あるいは3コピー以上(増幅)となっている現象。
(注7)機能喪失(型)
遺伝子の機能を減じたり消失させたりすること。対義語は機能獲得。
(注8)アイソフォーム
単一の遺伝子から類似した複数のタンパクを生じることがあり、それら一連のタンパクをアイソフォームと呼ぶ。CIC遺伝子においては、CIC-LとCIC-Sがアイソフォームの関係にある。以前からCIC-Sはよく知られていたが、CIC-Lの存在はごく最近に報告された。
(注9)制御性T細胞
Foxp3の発現により特徴づけられるTリンパ球の一種である。制御性T細胞あるいは活性化T細胞はATLの発生母体であるともいわれている。
(注10)びまん性大細胞型B細胞性リンパ腫
Bリンパ球由来の悪性リンパ腫の一種。悪性リンパ腫の中で最も患者数が多い病型であり、全リンパ腫のおよそ30~40%を占める。
(注11)分子分類
遺伝子異常の有無や遺伝子発現の違いといった情報によって腫瘍の亜型を分類すること。本研究においては、全ゲノム解析に基づく遺伝子異常の有無のみを用いてATLを分類した。
参考文献
Whole-genome landscape of adult T-cell leukemia/lymphoma.
Kogure Y, Kameda T, Koya J, Yoshimitsu M, Nosaka K, Yasunaga JI, Imaizumi Y, Watanabe M, Saito Y, Ito Y, McClure MB, Tabata M, Shingaki S, Yoshifuji K, Chiba K, Okada A, Kakiuchi N, Nannya Y, Kamiunten A, Tahira Y, Akizuki K, Sekine M, Shide K, Hidaka T, Kubuki Y, Kitanaka A, Hidaka M, Nakano N, Utsunomiya A, Sica RA, Acuna-Villaorduna A, Janakiram M, Shah U, Ramos JC, Shibata T, Takeuchi K, Takaori-Kondo A, Miyazaki Y, Matsuoka M, Ishitsuka K, Shiraishi Y, Miyano S, Ogawa S, Ye BH, Shimoda K, Kataoka K.
Blood. 2022 Feb 17;139(7):967-982. doi: 10.1182/blood.2021013568.
【本研究に先行する参考文献】
- 内丸 薫. I. HTLV-1関連疾患の疫学. 日本内科学会雑誌. 106巻7号. p.1370-5 (2017). doi: 10.2169/naika.106.1370.
- Integrated molecular analysis of adult T cell leukemia/lymphoma.
Kataoka K, Nagata Y, Kitanaka A, Shiraishi Y, Shimamura T, Yasunaga J, et al.
Nat Genet. 2015 Nov;47(11):1304-15. doi: 10.1038/ng.3415. - Aberrant PD-L1 expression through 3'-UTR disruption in multiple cancers.
Kataoka K, Shiraishi Y, Takeda Y, Sakata S, Matsumoto M, Nagano S, et al.
Nature. 2016 Jun 16;534(7607):402-6. doi: 10.1038/nature18294.

左より:片岡圭亮(血液内科学教室教授)、木暮泰寛(同非常勤講師)
最終更新日:2022年4月1日
記事作成日:2022年4月1日