研究の背景と概要
iPS細胞(注1)は、無限の増殖能力および生体内におけるほぼ全ての細胞系列への分化能力、いわゆる「多能性」を持つことから、再生医療や発生生物学において重要なリソースとなっています。これまでマウスやヒトを始めとしてさまざまな哺乳動物からのiPS細胞の樹立が報告されてきましたが、iPS細胞誘導に用いたリプログラミング因子(注2)が残存すると、移植実験に用いた際の腫瘍形成や細胞分化における異常が起こることが知られており、リプログラミング因子が完全に消失したiPS細胞の樹立が近年の重要な研究課題となっています。これまで、ヒト、マウス、ラットにおいてはその樹立が達成されてきましたが、それ以外の動物種においては非常に困難であるとされておりました。
研究の成果と意義・今後の展開
本研究では、まず小型霊長類であるコモンマーモセット(注3)の皮膚から採取した線維芽細胞を用いてリプログラミング因子が消失したiPS細胞の樹立法を検討しました。培地条件(数種類の小分子化合物や成長因子)や導入遺伝子セット(プラスミドベクター)を検討した結果、胎仔および成体の由来の線維芽細胞からiPS細胞を効率的に樹立する方法を確立しました。さらに、この方法で樹立したiPS細胞は、三胚葉(注4)性の細胞や始原生殖細胞(注5)様の細胞にも分化する能力があることも分かりました。
また、同様の方法を用いて他の種(イヌ、ブタ、フェレット)から採取した線維芽細胞にも応用を試みたところ、マーモセット同様にリプログラミング因子が消失したiPS細胞の樹立が可能であることが明らかになりました。それによって、本研究において開発したリプログラミング法を用いることで、分類学的には哺乳動物(哺乳綱)における様々な目(霊長目、食肉目、鯨偶蹄目)の動物から、統一された方法で高品質なiPS細胞の樹立が可能となりました。
さらに、本方法で線維芽細胞から最初に誘導される中間の細胞は神経幹細胞に似た性質(高い神経分化能、神経幹細胞特異的な遺伝子発現パターン)を示すことも明らかとなり(図1)、今後のリプログラミング研究において、この状態の細胞の可塑性を利用する事でさらなるリプログラミングの効率化が期待されます。
よって本研究では、多種の動物モデルを用いた幹細胞リソースの整備に向けた基盤となる重要な知見が得られました。今後の幹細胞を用いた再生医療の研究や、人工配偶子誘導による品種改良などのさまざまな応用も期待されます。
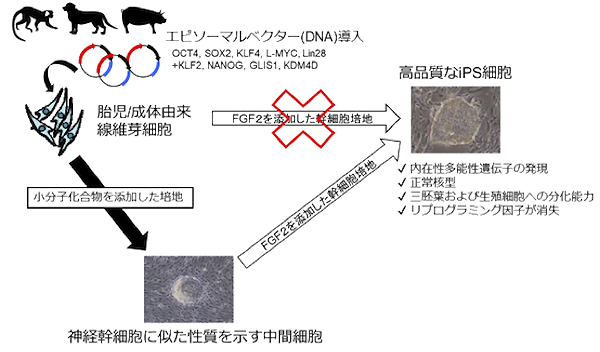
図1. 本研究の概要
小分子化合物を添加する新しい培養条件の発見により、これまで困難とされていた動物種のiPS細胞の樹立を可能とした。
【用語解説】
(注1)iPS 細胞
Induced pluripotent stem cell(人工多能性幹細胞)。線維芽細胞(皮膚由来の細胞)や血球細胞などの終末分化した体細胞に特定の転写因子を遺伝子導入することによって、生体内のあらゆる組織や細胞への分化能と自己増殖能を再獲得した細胞。2006年に京都大学の山中伸弥教授らによって初めて報告された
(Takahashi et al., Cell 2006)。
(注2)リプログラミング因子
2006年に山中教授らが胚性幹細胞で強く発現する遺伝子の中からOCT4, SOX2, KLF4, C-MYCの4因子がiPS細胞誘導に重要であることを同定したほか、これまでにNANOG, LIN28,GLIS1などの誘導効率に関わる重要な遺伝子が発見されている。
(注3)コモンマーモセット
ブラジル原産の小型霊長類で、ラットより一回り大きい程度の体長と高い繁殖能力を持ち、ヒトに近似な脳科学モデルとして近年注目を集めている(井上 貴史、佐々木 えりか 脳科学辞典
https://bsd.neuroinf.jp/wiki/コモンマーモセット (2021))。
(注4)三胚葉
脊椎動物において、胚発生後に最初に分かれる3種類の細胞集団を指す(胎盤や羊膜等の胚体外組織を含まない)。具体的には、外胚葉(神経や表皮、感覚器に分化)、中胚葉(骨、筋肉、結合組織、心臓、血管、血液や性腺に分化)、内胚葉(消化管や肺・膵臓・肝臓などの臓器に分化)の3種類の総称として三胚葉と呼ぶ。
(注5)始原生殖細胞
オスにおいては精子、メスにおいては卵子を形成する生殖系列の細胞(三胚葉とは別の分類とされる)のうち、胚発生において最も初期に出現する細胞。成熟分化後に減数分裂を経て配偶子(精子・卵子)となる。
参考文献
-
Non-viral Induction of Transgene-free iPSCs from Somatic Fibroblasts of Multiple Mammalian Species.
Yoshimatsu S, Nakajima M, Iguchi A, Sanosaka T, Sato T, Nakamura M, Nakajima R, Arai E, Ishikawa M, Imaizumi K, Watanabe H, Okahara J, Noce T, Takeda Y, Sasaki E, Behr R, Edamura K, Shiozawa S, Okano H.
Stem Cell Reports. 2021 Apr 13;16(4):754-770. doi: 10.1016/j.stemcr.2021.03.002. Epub 2021 Apr 1.
-
Non-viral derivation of a transgene-free induced pluripotent stem cell line from a male beagle dog.
Yoshimatsu S, Edamura K, Yoshii Y, Iguchi A, Kondo H, Shibuya H, Sato T, Shiozawa S, Okano H.
Stem Cell Res. 2021 May;53:102375. doi: 10.1016/j.scr.2021.102375. Epub 2021 Apr 29.
-
Establishing an induced pluripotent stem cell line from neonatal common marmoset fibroblasts by an all-in-one episomal vector approach.
Yoshimatsu S, Qian E, Sato T, Yamamoto M, Ishikawa M, Okano H.
Stem Cell Res. 2021 May;53:102380. doi: 10.1016/j.scr.2021.102380.
-
Establishment of an induced pluripotent stem cell line from a female domestic ferret (Mustela putorius furo) with an X chromosome instability.
Yoshimatsu S, Murakami R, Nakajima M, Sato T, Kawasaki H, Okano H.
Stem Cell Res. 2021 May;53:102385. doi: 10.1016/j.scr.2021.102385.

左より:岡野栄之(生理学教室教授)、吉松祥(同訪問研究員)
最終更新日:2021年7月1日
記事作成日:2021年7月1日