研究の背景
シェーグレン症候群 は、涙腺・唾液腺等の慢性的な炎症により、ドライアイ 、ドライマウスなどの乾燥症状を起こす自己免疫疾患です。ヒトの免疫系では、一度侵入した病原体を記憶し、再度同じ病原体が侵入した場合に速やかに排除するために、「抗体」と呼ばれる成分が作られます。ところが、自己免疫疾患の患者さんは血液中に自己の成分に対する抗体である「自己抗体」が検出されることが知られています。シェーグレン症候群では約70%の患者さんに抗SSA抗体もしくは抗SSA抗体と抗SSB抗体両方が認められ、約15%の患者さんに抗セントロメア抗体が認められます。抗SSA/SSB抗体はシェーグレン症候群でみられる代表的な自己抗体とされ、旧厚生省の診断基準に含まれていますが、抗セントロメア抗体は別の自己免疫疾患である全身性強皮症や原発性胆汁性胆管炎でも出現することもあり、シェーグレン症候群の診断における位置付けが確定していませんでした。
また、以前より様々な自己免疫疾患の病変組織には自己抗体を産生している細胞がいる、という少数の研究報告がなされており、シェーグレン症候群でも抗SSA/SSB抗体を産生する細胞が唾液腺組織に存在することが言われていました。本研究では、抗SSA/SSB抗体陽性の患者さんに加え、抗セントロメア抗体陽性の患者さんについても唾液腺組織でどのような抗体が作られているのか、最新の技術を用いて解析を試みました。
研究の概要
本研究は当科と歯科・口腔外科の共同研究です。本研究では唾液腺に浸潤している抗体産生細胞を1つ1つ解析し、それぞれの細胞が作っている抗体の遺伝子データを取得しました。そのデータに基づき、試験管内で実際に250種類を超える抗体を作成し、それらの抗体が何に反応するのかを詳細に調べました。
その結果、血液中で抗SSA/SSB抗体が陽性の患者さんの唾液腺では抗SSA/SSB抗体が、血液中で抗セントロメア抗体が陽性の患者さんの唾液腺では抗セントロメア抗体が作られており、唾液腺に存在する抗体産生細胞の3割程度が自己抗体産生細胞である事が分かりました。この高い比率と抗体の配列情報の解析結果から、これらの自己抗体産生細胞は別の場所で出来たものが病変に侵入しているのではなく、唾液腺での持続的な免疫応答の結果として出来てきている事が分かりました。このことから、今まで意義付けが曖昧だった抗セントロメア抗体は、抗SSA/SSB抗体と同じくらいシェーグレン症候群と密接に関わっていることが分かりました。
また、今回作成した抗体の中に、今まで抗セントロメア抗体として報告がないタンパク質複合体である「MIS12複合体」に対する抗体があることを見つけました(図1)。そのため私たちは、このMIS12複合体に対する抗体と、今まで抗セントロメア抗体として報告されているCBX5、CENP-A/B/Cに対する抗体の有無を、健常人、シェーグレン症候群、全身性強皮症、原発性胆汁性胆管炎の患者さんの血清で調べました。その結果、MIS12複合体に対する抗体は従来の抗セントロメア抗体検査で陰性の患者さんの血清からも検出され、従来法よりも高い検出力があることが分かりました。
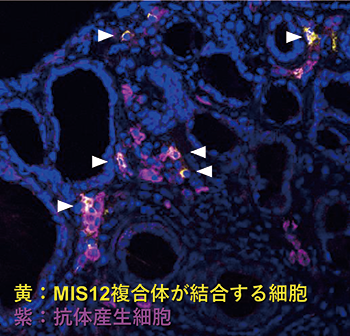
図1. シェーグレン症候群の唾液腺に存在するMIS12複合体に対する抗体を産生する細胞 (白矢印)
さらに、抗セントロメア抗体陽性とされる患者さんは、多種のセントロメア構成タンパク質に対する抗体を同時に併せ持っていることが分かり、この特徴は疾患を超えて共通していました。従来の考え方では、「各疾患の一部の患者さんで抗セントロメア抗体が出て、それぞれの疾患の関連は不明」とされていますが、本研究結果からは、「抗セントロメア抗体陽性の患者さんは、シェーグレン症候群、全身性強皮症、原発性胆汁性胆管炎の病状のどれかまたは複数が出現する、独立した特徴を持つ一群の患者さんである」という新しい疾患概念が示唆されました(図2)。こういった、自己抗体で疾患を特徴づける、分類するという考え方は、抗リン脂質抗体や抗ARS抗体といった自己抗体でも提唱されており、今後の病態のよりよい理解につながると考えられます。
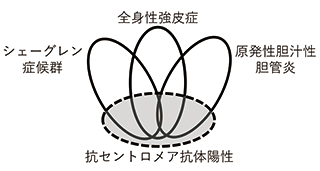
図2. 抗セントロメア抗体の新しい位置付け
今後の展望
本研究によってシェーグレン症候群の病変局所での自己抗体の成り立ちが明らかになったことは、今後の病態解明につながる重要な手がかりになると考えられます。さらに、今後は抗セントロメア抗体陽性の患者さんの臨床症状の特徴を詳細に解析することで、自己抗体の種類による疾患の分類や病態の理解が進むことが期待されます。
参考文献
Antigen-driven selection of antibodies against SSA, SSB and the centromere 'complex', including a novel antigen, MIS12 complex, in human salivary glands.
Takeshita M, Suzuki K, Kaneda Y, Yamane H, Ikeura K, Sato H, Kato S, Tsunoda K, Arase H, Takeuchi T.
Ann Rheum Dis. 2020 Jan;79(1):150-158. doi: 10.1136/annrheumdis-2019-215862. Epub 2019 Oct 14
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6937410/
![]()

左より:竹下勝(リウマチ・膠原病内科学教室特任助教)、角田和之(歯科・口腔外科学教室専任講師)、鈴木勝也(リウマチ・膠原病内科学教室専任講師)
最終更新日:2020年5月1日
記事作成日:2020年5月1日