研究の背景
生まれつき心臓に病気を持つ「先天性心疾患 」の子どもたちは、1歳までに死亡してしまう場合もいまだに多く、生涯にわたって医療を必要とします。先天性心疾患には、様々な心臓の構造の異常があり、特に心臓から体と肺に血液を送り出す2本の血管、大動脈と肺動脈が出る部分である心臓の出口(流出路)の異常は、先天性心疾患の約30%を占めています。重症な流出路の異常である「総動脈幹症」では、心臓から出る血管は1本しかなく、体と肺に酸素を多く含んだ動脈血と酸素の少ない静脈血を分けて送り出すことができず、生まれてすぐに緊急治療が必要です。このとき、肺の中の肺動脈がきちんと形成されているかどうかは、治療成績や予後に大きく影響します(図1)。このような総動脈幹症や肺動脈の形成異常が、どのように発生するのかはよくわかっていません。そこで「LacZマーカー」という、細胞を青く染めるためによく使用される遺伝子を導入した遺伝子改変マウスで、肺動脈の発生の過程を青く染めて(顕微鏡下で)目で見えるようにして、総動脈幹症および肺動脈の形成異常がどのように発症するかを探りました。
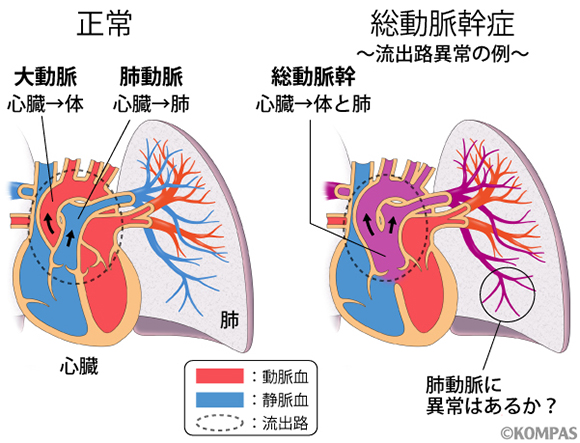
図1. 先天性心疾患の約30%を占める流出路異常とそれに伴う肺動脈の異常を考える
研究の概要
この研究では、IP3R2-LacZマウスという遺伝子改変マウスを解析しました。このマウスでは、細胞内のカルシウムを調節するIP3R2(注1)と呼ばれるタンパクが発現する細胞でLacZという酵素を発現するため、X-galを基質とした酵素反応によってマウスの胎仔を染色することにより、本来IP3R2が発現する細胞が青く染まります。しかし、それ以外は全く正常に生まれて、病気もなく生きていくことができるマウスです。
肺動脈の発生
胎生11.5日(注2)、肺動脈に平滑筋が初めて確認される時期に、このマウスでは流出路から肺に向かう2本の肺動脈が青く染まった血管として確認できました(図2 A矢頭)。その後、胎生が進むにつれ、肺動脈が徐々に枝分かれしながら肺の末端まで広がっていく様子を、青く染めて可視化することに成功しました(図2 B,C)。胎生18.5日のIP3R2-LacZマウスの肺を詳しく観察したところ、肺動脈の平滑筋だけが青く染まっていることがわかりました(図2 D)。この解析によって、肺動脈平滑筋は心臓流出路から徐々に肺の末梢に広がっていく様式で発生することが明らかにされました。
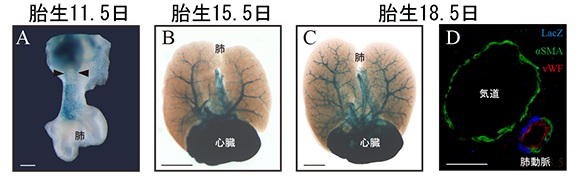
図2. 肺の発生と共に肺動脈平滑筋は肺の末梢に広がっていく
A :肺だけを取り出し、正面から見たもの。黒矢頭で示している青く染まっている部分は、左右の肺動脈平滑筋が発生する場所と一致している。
B,C:心臓と肺を一緒に取り出し、頭側から見たもの。青色の肺動脈は徐々に枝分かれし、末梢まで広がっていく。
D :Cの免疫組織像を画像的に重ね合わせたもの。青色の部分は気道にはなく、肺動脈のみで確認できる。青色の部分は、緑色の平滑筋マーカー(αSMA)と同じ場所で、赤色の血管内皮マーカー(vWf)とは異なる場所であり、青色の部分は肺動脈平滑筋だった。
スケールバー=200μm(A)、1mm(B,C)、50μm(D)
総動脈幹症の発症病態の解明
心臓流出路は、初期には動脈幹と呼ばれる1本の管状構造が、発生の過程で大動脈と肺動脈の2本の血管に分かれて形成されます。IP3R2-LacZマウスの解析を続けると、肺動脈中膜の平滑筋の染まり方は、心臓に近い基部では弱く(図3 A)、肺動脈が左右に分岐する辺りから強くなることがわかりました(図3 B矢印)。そこで、総動脈幹症を発症するモデルマウスとIP3R2-LacZマウスを交配し、総動脈幹症の発症病態の解明を試みました。総動脈幹症モデルマウスとしては、ヒトで総動脈幹症を高率に合併する22q11.2欠失症候群(注3)の主要病因遺伝子であるTBX1の発現が低下している遺伝子改変マウスを用いました。このマウスでは、IP3R2-LacZマーカーによって、流出路から出る1本だけの血管の基部の平滑筋が強く青く染まり(図3 C矢頭)、先に見られた弱く染まる部分(図3 A)がありませんでした。以上の結果より、この総動脈幹症の発症には、肺動脈の基部が形成されないために2本の血管に分かれるはずの流出路が1本の出口のまま残ってしまうという病態が関与することが解明されました。
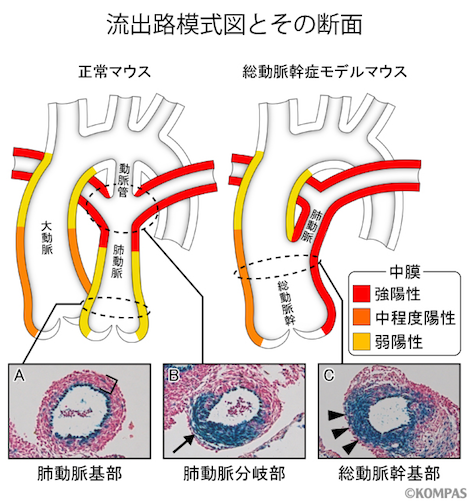
図3. 総動脈幹症モデルマウスでは正常マウスで見られる肺動脈基部がなく、流出路が1本のまま残る
正常マウスでは肺動脈基部の中膜(A角かっこ)では青色の染まりが弱く、肺動脈分岐部の肺動脈側(B矢印)では強い。
総動脈幹症モデルマウスでは黒矢頭で示しているように総動脈幹基部から染まりの強い部分(C矢頭)が持続。
総動脈幹症モデルマウスの肺の異常
さらに、総動脈幹症モデルマウスの肺を解析しました。胎生17.5日までは青い染まり方に異常はありませんでしたが、胎生18.5日では、正常マウスと比べると青く染まった肺動脈の末端の方の伸びが悪く、肺自体も小さめでした(図4 A,B)。肺の組織を顕微鏡で詳しく観察すると、ガス交換をする場である肺胞の隔壁が厚く、肺胞の腔は狭くなっていました(図 4 C,D)。また、電子顕微鏡写真ではサーファクタント(注4)は認めるものの、肺胞上皮細胞にグリコーゲン(注5)が多く貯留していて(図4 E,F)、肺の17.5日から18.5日、すなわち出生直前の肺の成熟が障害されていることが明らかになりました。
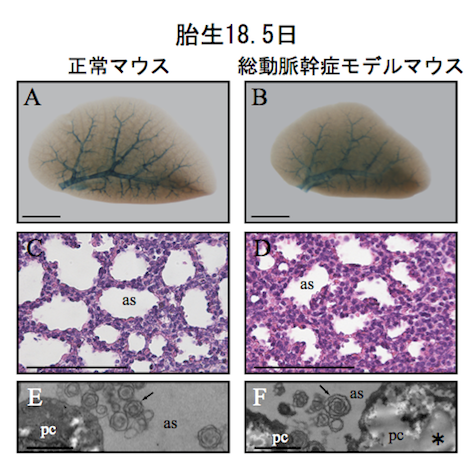
図4. 総動脈幹症モデルマウスの肺は胎生18.5日で成熟が障害されていた
A,B :肺の一葉を取り出したもの。青く染まった肺動脈の分岐に差は無いが、総動脈幹症モデルマウスの肺動脈末端の伸びは悪く、肺が小さい。
C,D: 肺の組織像。総動脈幹症モデルマウスの肺胞腔(as)は狭く、肺胞腔と肺胞腔の間は細胞が多く、厚いままだった。
E,F :電子顕微鏡写真。肺胞腔(as)に見られるサーファクタント(矢印)はどちらにも確認出来るが、総動脈幹症モデルマウスでは肺胞上皮細胞(pc)内にグリコーゲン(*)が多く存在していた。
スケールバー=1mm(A,B)、100μm(C,D)、2μm(E,F)
今後の展望
今回、IP3R2-LacZマウスという、これまでになかった肺動脈の発生を可視化することができる有用な実験動物を確立することができました。また、このマウスを「LacZマーカー」として、先天性心疾患および肺動脈の形成異常の発症病態の解明に応用することができました。先天性心疾患の診療を向上させるために、病態解明と予防・再生医療に発展する基礎研究は重要です。今世紀、心臓流出路の発生において、2つの心臓前駆細胞である心臓神経堤細胞と二次心臓領域細胞の相互作用が明らかとなり、様々な心臓流出路異常が形成される病態に新たな概念が生まれました。複雑な心臓の発生を制御する多くの遺伝子が、どのように形態形成に機能しているのか、また、その異常によってどのように先天性心疾患が発症するのかを解明することが課題です。私たちの研究成果を、さらに多くのヒト先天性心疾患の病態解明に応用していきたいと考えています。
【用語解説】
(注1)IP3R2
イノシトール3リン酸受容体(Inositol 1,4,5-trisphosphate receptor)2型。細胞内の小胞体上に存在するカルシウムチャネルの一つ。哺乳類には3種の亜型があり、2型は心血管系に強く発現する。
(注2)胎生〇日
受精してからの日数、マウスは約20日で生まれる。
(注3)22q11.2欠失症候群
染色体の一部が欠失して起こる症候群の一つ。疾患を引き起こす主要な遺伝子はTBX1であり、今回使用したマウスはこのTbx1の発現が25%に減少したTbx1neo/neoマウス。
(注4)サーファクタント
肺の中の酸素を体に取り込む袋である肺胞の中にある物質。これにより、肺は肺胞表面の水の表面張力と拮抗して十分な拡張が可能になり、効率的に肺胞に空気を取り込むことが出来る。肺の成熟に伴い出来てくる。
(注5)グリコーゲン
糖分が蓄えられたもの。Ⅱ型肺胞上皮細胞のグリコーゲンは成熟すると消失する。
参考文献
Inositol 1,4,5-trisphosphate receptor 2 as a novel marker of vasculature to delineate processes of cardiopulmonary development.
Ishizaki-Asami R, Uchida K, Tsuchihashi T, Shibata A, Kodo K, Emoto K, Mikoshiba K, Takahashi T, Yamagishi H.
Dev Biol. 2020 Feb 15;458(2):237-245. doi: 10.1016/j.ydbio.2019.11.011. Epub 2019 Nov 20.

小児循環器研究室メンバー
前列左から:山岸敬幸(小児科学教室教授)、石崎怜奈(同助教)、内田敬子(保健管理センター専任講師)
最終更新日:2020年4月21日
記事作成日:2020年4月21日