研究の背景
副腎は、多様なステロイドホルモンを大量に産生する臓器です。マウスやラットの副腎皮質は層状の構造を持ち、それぞれの層がアルドステロン(注1)、コルチゾル、および性ホルモンを産生することが知られていました。ところが、ヒト成人の副腎皮質は層状というよりむしろ斑入り状です。中でも、かたまり状のアルドステロン産生細胞部位 (aldosterone-producing cell cluster:以下、APCC)(注2)が主なアルドステロン産生部位である可能性を、我々研究グループはアルドステロン合成に必須の酵素 (アルドステロン合成酵素) を検出することにより報告してきました(文献1、2)。APCCは過剰にアルドステロンを産生して、高血圧症の原因となっている可能性があります。さらにAPCCは、アルドステロン産生腺腫 (aldosterone-producing adenoma:以下、APA) (注3)という重症高血圧を来す原発性アルドステロン症(注4)という病気の病変に移行する可能性があります。実際に、APCCからAPAへの移行を示唆する病変 (possible APCC-to-APA transitional lesion: 以下、pAATL) もこれまでに見出してきました(図1)(文献3)。しかし、0.2mmから1㎜程度の小さなAPCCが実際にアルドステロンを産生するかどうかは検証が難しく、実証には至っていませんでした。
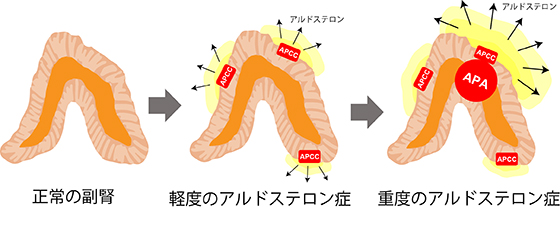
図1. 原発性アルドステロン症の進展に伴う、アルドステロン産生細胞の変遷 (模式図)
研究の概要
今回、新しい分子のイメージング手法である高感度イメージング質量分析法(注5)により、微小なAPCCにおけるアルドステロンの集積を、組織切片上 (組織を薄く切って、スライドガラスに張り付けたもの) でイメージとして捉えることに成功しました。この結果から、APCCがアルドステロンを産生する証拠を提示することができました。また、APCCよりも巨大なpAATLやAPAにおいて大量のアルドステロンが産生されている様子も視覚化しました(図2、3)。
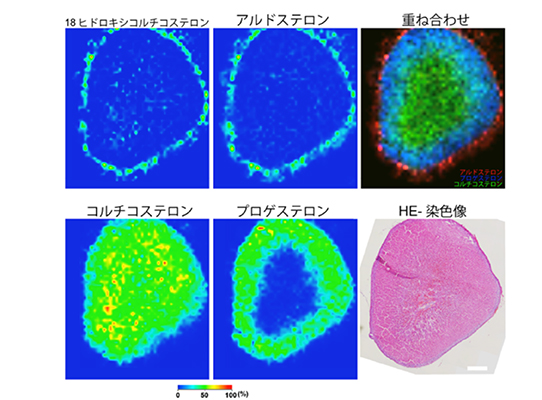
図2.
ラット副腎におけるステロイド産生パターンを高感度イメージング質量分析法により捉えた例。
マウスやラットでは層状のステロイド産生細胞層が存在することを実証した。
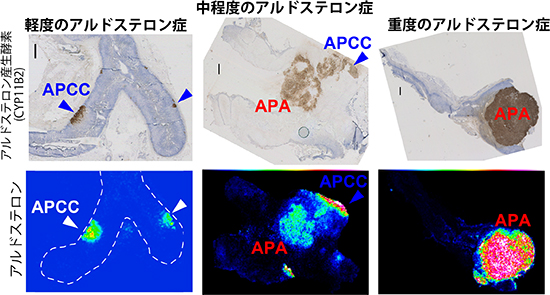
図3.
アルドステロン症患者の副腎検体において、アルドステロン分布を画像化した例。重症度が異なると、異なる組織形態の細胞がアルドステロンを産生していることを画像として捉えた例。
さらに、今回用いたイメージング質量分析を用いると、狙った既知分子のみでなく、未知の分子を探索することができます。本研究においても、腫瘍には検出されるが、正常の副腎皮質細胞には検出されない特殊なステロイドホルモンを複数種、イメージング画像として視覚化しました。これらの腫瘍で作られるステロイド分子種は、血中で検出することにより原発性アルドステロン症の診断に寄与します。したがって今回の研究成果は、既知のステロイドホルモンの可視化に限らず、今後のアルドステロン産生病変を診断するための新規バイオマーカー開発につながることが期待されています。
【用語解説】
(注1)アルドステロン
体内に水分や塩分を保持する重要なステロイドホルモン。
(注2)APCC (Aldosterone-producing cell cluster)
アルドステロン産生酵素を強く発現する、通常0.2mmから1㎜程度の粒状の細胞群。以前より原発性アルドステロン症患者の摘出副腎に見られることは知られていたが、実際にアルドステロンを産生する様子は未観察であった。
(注3)APA (Aldosterone producing adenoma)
アルドステロン産生酵素を強発現する腫瘍。通常3mm以上の大きさ。実際にアルドステロンを産生する様子を画像として観察した報告はなかった。
(注4)原発性アルドステロン症
アルドステロンが過剰 (自律的) に産生され、重度の高血圧となる疾病。以前は、原発性アルドステロン症は希少な疾患であると考えられていたが、現在は高血圧患者の約10%が本疾患であると診断される。原発性アルドステロン症は主に、アルドステロン産生腺腫あるいは原因が分からない特発性アルドステロン症の2つに分類される。
(注5)高感度イメージング質量分析法
質量分析を分子イメージング法に適用した画像化法を、研究グループが「組織上誘導体化法」や「超高分解能質量分析計」の導入により、従来よりはるかに高感度にしたもの。
参考文献
Aldosterone and 18-Oxocortisol Coaccumulation in Aldosterone-Producing Lesions.
Sugiura Y, Takeo E, Shimma S, Yokota M, Higashi T, Seki T, Mizuno Y, Oya M, Kosaka T, Omura M, Nishikawa T, Suematsu M, Nishimoto K.
Hypertension. 2018 Dec;72(6):1345-1354.
【本研究に先行する参考文献】
- Adrenocortical zonation in humans under normal and pathological conditions.
Nishimoto K, Nakagawa K, Li D, Kosaka T, Oya M, Mikami S, Shibata H, Itoh H, Mitani F, Yamazaki T, Ogishima T, Suematsu M, Mukai K.
J Clin Endocrinol Metab. 2010 May;95(5):2296-305.
- Aldosterone-stimulating somatic gene mutations are common in normal adrenal glands.
Nishimoto K, Tomlins SA, Kuick R, Cani AK, Giordano TJ, Hovelson DH, Liu CJ, Sanjanwala AR, Edwards MA, Gomez-Sanchez CE, Nanba K, Rainey WE.
Proc Natl Acad Sci U S A. 2015 Aug 18;112(33):E4591-9.
- Case Report: Nodule Development From Subcapsular Aldosterone- Producing Cell Clusters Causes Hyperaldosteronism.
Nishimoto K, Seki T, Kurihara I, Yokota K, Omura M, Nishikawa T, Shibata H, Kosaka T, Oya M, Suematsu M, Mukai K. J Clin Endocrinol Metab. 2016 Jan;101(1):6-9. - Aldosterone-stimulating somatic gene mutations are common in normal adrenal glands.

左から、杉浦悠毅(医化学教室専任講師)、西本紘嗣郎(同非常勤講師、埼玉医科大学国際医療センター泌尿器腫瘍科准教授)
最終更新日:2019年4月1日
記事作成日:2019年4月1日