研究の背景
ヒト多能性幹細胞(注1)である胚性幹細胞(ES細胞)や人工多能性幹細胞(iPS細胞)は、私たちの体を構成する様々な細胞に分化可能であり、再生医療や新薬の開発研究への応用が期待されています。しかし、ES/iPS細胞の分化誘導法は培養条件が複雑な上に、胚様体や前駆細胞を経由させ段階的に細胞を分化させるため、1) 比較的長期間の培養期間を要する、2) 分化誘導効率が十分ではない、3) 異なる細胞系譜の細胞が混在する、など問題がありました。そこで我々は、ES/iPS細胞内の遺伝子発現状態を人工的に操作することによって、目的の細胞を効率よく、かつ迅速に作り出すための新たな方法を検討してきました。細胞に発現する遺伝子の種類は、特定の転写因子(注2)のセットによって規定されています。転写因子は遺伝子発現を直接的に制御する因子であり、プロモーターやエンハンサーといった転写を制御する領域に結合することで、DNAの遺伝情報をRNAに転写する過程を促進、あるいは抑制し、細胞特異的な遺伝子発現パターンを構築します。この原理に基づき、分化に関わる遺伝子群の働きをオンにする転写因子を人工的にES/iPS細胞へ導入させれば、自在な分化誘導が可能であると期待されています。
しかしながら、ES/iPS細胞には、高い未分化性を維持する機構が存在し、分化に関わる転写因子を導入しても、迅速な分化が行われないという問題点がありました。事実、比較的分化誘導を起こしやすい線維芽細胞を骨格筋細胞へと形質転換させるマスター転写因子MYOD1の導入による分化誘導にすら、ES/iPS細胞は高い抵抗性を示します。今回、我々はES/iPS細胞が分化誘導に示す抵抗性の原因の1つを解明し、この知見をもとに転写因子を用いた分化誘導法を改良し、ES/iPS細胞から骨格筋細胞を効率よく分化誘導させることに成功しました。
研究の概要
近年、転写因子をコードする合成RNA(注3)を試験管内で作製し、ES/iPS細胞に導入する方法が開発され、ゲノム改変を伴わない簡便かつ安全な分化誘導系として広く普及しつつあります。そこで我々は、同様の方法によって筋細胞分化のマスター転写因子であるMYOD1の合成RNAをES/iPS細胞に導入し分化誘導されるのか検証しましたが、ほとんどの細胞は未分化状態を維持したままでした。分化誘導を阻害する遺伝子を特定するため、免疫染色法によりMYOD1の導入された細胞に存在する複数の未分化関連因子の発現を調べた結果、未分化性を担う遺伝子POU5F1(OCT3/4)(以下、POU5F1)が残存していることが分かりました(図1)。また、POU5F1があるとMYOD1が遺伝子を制御するゲノム領域に結合できないことも明らかとなり、この分子がMYOD1の働きを妨げている可能性が考えられました。
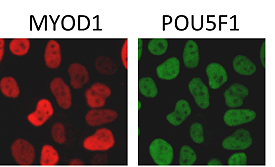
図1.MYOD1の合成RNAを導入した多能性幹細胞
MYOD1を導入してもPOU5F1が残存しているためMYOD1は機能することができない。
そこでPOU5F1を選択的に抑制するsiRNAと MYOD1の合成RNAを合わせたカクテル(細胞分化RNAカクテル)を作成し、ES/iPS細胞に添加したところ、分化誘導開始から5日目に80%の細胞が骨格筋マーカーであるMyHCを発現していました。また、この細胞はサルコメア構造や融合能を有する機能的な骨格筋細胞であることが分かりました。従来のMYOD1の合成RNAを単独で導入する手法ではMyHC発現を指標にした分化効率が6%であったことから、今回の手法は、機能的な骨格筋細胞の生産性の効率を大きく向上させたといえます(図2)。
さらに網羅的な遺伝子発現解析を行った結果、POU5F1の抑制は骨格筋細胞分化に必須な成長因子の発現を促していることを発見しました。このことから、POU5F1の抑制はES/iPS細胞の未分化性を解除するだけでなく、多元的に分化誘導をサポートすることが示唆されました。
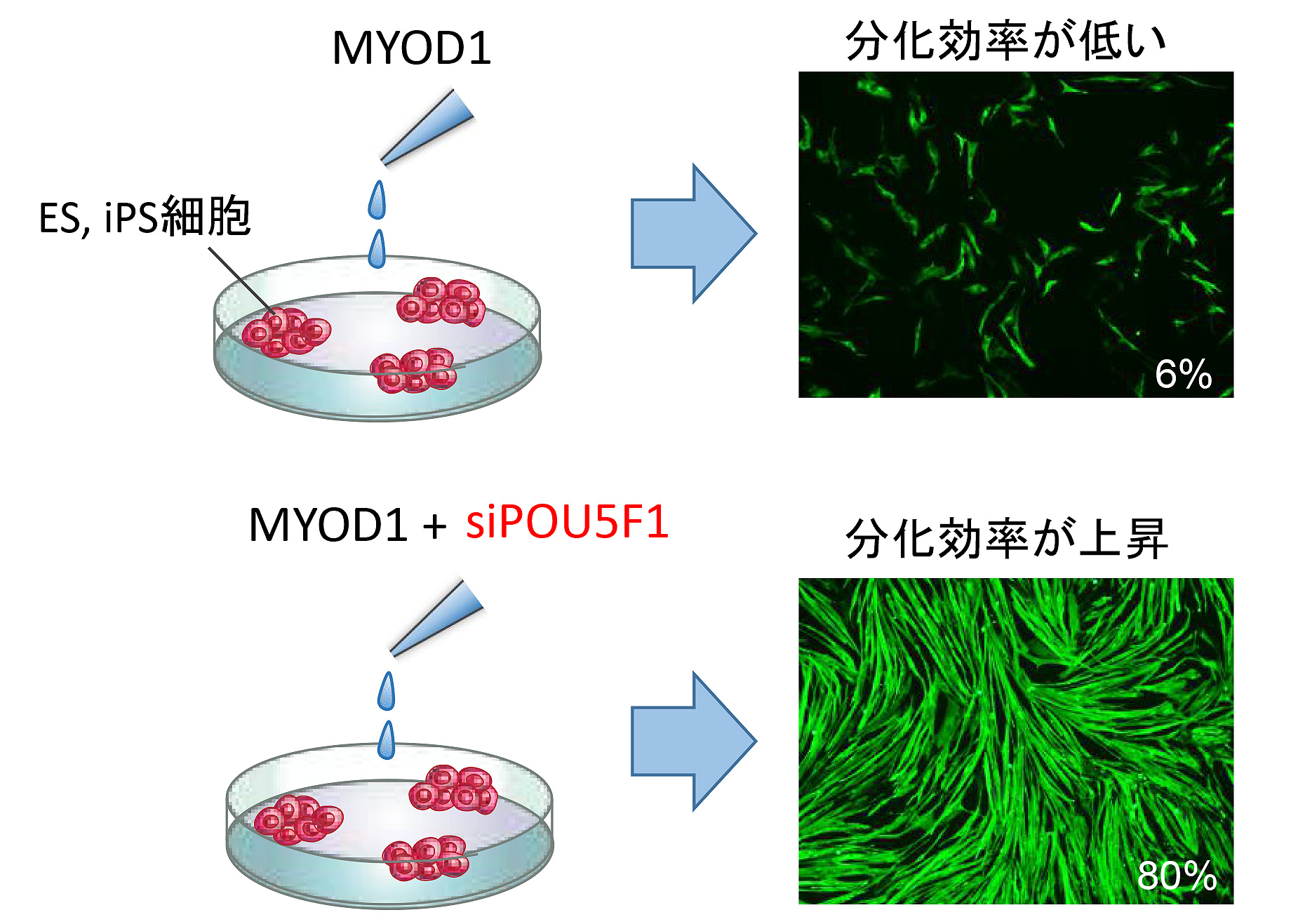
図2. 骨格筋細胞を示す免疫染色像
MYOD1の合成RNAを添加してもES細胞やiPS細胞から骨格筋細胞(緑)はほとんどできないが、POUSF1を抑制するRNA(siPOUSF1)を同時に添加すると分化効率が上昇する。
今後の展望
「細胞分化RNAカクテル」を用いて、骨格筋細胞へと分化誘導した場合、複数のES/iPS細胞株で効率よく、短期間で骨格筋細胞を得ることができます。今回の結果は、骨格筋細胞の基礎研究のみならず、骨格筋の異常で起こる筋ジストロフィーなど様々な病気の病態解明、治療薬の開発などに役立つことが期待されます。さらに、POU5F1の抑制は、ES/iPS細胞の未分化性を解除するため、骨格筋細胞だけでなく、ほかの細胞系譜への分化誘導にも応用可能であると考えられます。ES/iPS細胞にMYOD1以外の転写因子を用いたRNAカクテルを導入すれば、これまで分化誘導が困難であった組織や器官の細胞を高効率に作製できることが期待されます。
【用語解説】
(注1) ヒト多能性幹細胞
発生初期の細胞のように、体を構成するさまざまな細胞に分化する能力を持つ培養細胞
で、胚盤胞に由来する胚性幹細胞(ES 細胞)と体細胞に 由来する人工多能性幹細胞(iPS 細胞)がある。
(注2) 転写因子
DNA に結合するタンパク質で特定の遺伝子発現レベルを調節する。
(注3) 合成 RNA
遺伝子 DNA を型枠に見立てて、試験管の中で合成される。細胞の中に 導入されると自
然に存在する mRNAと同じように、タンパク質の合成が行われる。
参考文献
Efficient differentiation of human pluripotent stem cells into skeletal muscle cells by combining RNA-based MYOD1-expression and POU5F1-silencing.
Akiyama T, Sato S, Chikazawa-Nohtomi N, Soma A, Kimura H, Wakabayashi S, Ko SBH, Ko MSH.
Sci Rep. 2018 Jan 19;8(1):1189. doi: 10.1038/s41598-017-19114-y.

左から、秋山智彦(坂口光洋記念講座(システム医学)助教)、洪実(同教授)
最終更新日:2019年1月7日
記事作成日:2019年1月7日