研究の背景
筋萎縮性側索硬化症(Amyotrophic Lateral Sclerosis、以下ALS)は、大脳皮質運動野の上位運動ニューロンあるいは脊髄前角の下位運動ニューロンの選択的細胞死を特徴とした致死性の神経変性疾患であり、いくつかの承認された治療薬はあるものの、根本治療には至っておらず、新たな治療戦略の開発が期待されています。全体の5~10%が単一の遺伝子の変異により発症する家族性(familial ALS、以下FALS)で、90%が非家族性に発症する孤発性(sporadic ALS、以下SALS)です。しかしながら、SALSの発症においても、遺伝学的な素因が少なからず寄与するものと考えられており、FALSの研究により、運動ニューロン変性における遺伝型と表現型の因果関係やそのメカニズムを徹底的に追求し、それに基づいた治療薬の開発を行い、SALSの治療に応用するという"From Rare to Common" というコンセプトに基づくALSの病態解明と治療法の開発を行いました。この過程で、人工多能性幹細胞(iPS細胞)技術や既存薬ライブラリーを用いた薬剤スクリーニングを駆使した展開を行い、ALS治療候補薬を見出すに至りました。
研究の概要
FALSに関して、これまで25の遺伝子座(ALS1~ALS25)の存在が明らかにされ、そのほとんどについて原因遺伝子産物が同定されています。これらFALSの原因遺伝子産物の機能解析などにより、RNA代謝異常、タンパク質の品質管理の異常、細胞骨格/細胞内輸送の異常、ミトコンドリアの機能異常、ERストレスの異常、酸化ストレスの亢進などの細胞自律的なメカニズムと、主にグリア細胞が関与する細胞非自律的なメカニズムによる運動ニューロンの選択的な細胞死がALSの本質的な病態であることが明らかになってきています。おそらく、SALSにおいても、同様なメカニズムがその発症に関与しているものと考えられています。 興味深いことに、FALSの中で、ALS6、ALS10、ALS20は、各々FUS、TDP-43(TARDBP)、hnRNPA1というプリオン様ドメインを有するRNA結合性蛋白質をコードしており、RNA代謝異常が関与する何らかの共通した発症機構が存在することを示唆しています。私たちの研究グループは、このRNA代謝異常とALSの関連性に注目した解析を行ってきました。2016年には、FUS遺伝子のミスセンス変異(H517D)を有するALS6の家系の患者2名よりiPS細胞を樹立し、運動ニューロンへと分化誘導し、原因遺伝子産物であるRNA結合タンパク質の核内から細胞質への局在異常、ストレス顆粒の形成、運動ニューロン死、ALS関連表現型がin vitroで起きることを確認し、論文を報告しております(文献1)。またALSの病態解析を加速するために、iPS細胞から迅速かつ高効率な運動ニューロン分化誘導法の開発を行いました(文献2、3)(図1)。
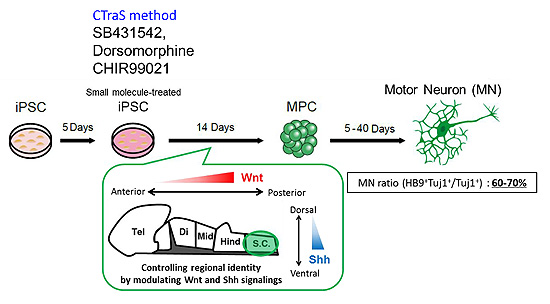
図1. 迅速かつ高効率な運動ニューロン分化誘導法の開発
(文献2、3より改変)
私たちは、さらに研究を進め、ALS10患者(TDP-43変異)由来のiPS細胞株(京都大学iPS細胞研究所・井上治久教授より分与)を用いた解析を行ったところ、原因遺伝子産物であるRNA結合タンパク質の核内から細胞質への局在異常、ストレス顆粒の形成、運動ニューロン死、神経突起の退縮といったALS関連表現型が、ALS6患者とALS10患者由来iPS細胞-運動ニューロンにおいて、ほぼ同様な時間経過で出現することが明らかとなりました(文献3)。
次に、この所見を活用し、ALS6患者とALS10患者由来iPS細胞から誘導した運動ニューロンを対象に、慶應義塾大学医学部の佐谷秀行教授が有している1232種の既存薬ライブラリーを用い、いわゆるDrug repositioningにより、ALS関連RNA結合タンパク質の局在異常、ストレス顆粒の形成、運動ニューロン死、神経突起の退縮といったALS関連の表現型を抑制する化合物をスクリーニングし、9つの薬剤を見出しました(図2)。ロピニロール塩酸塩(ROPI)は、この中でも9化合物の中で最も治療効果が大きく、D2受容体アゴニストとしてパーキンソン病の治療薬として世界中で広く使用され、日本でも保険適用となっている薬剤です。一方ROPIによる抗ALS活性は、その一部だけがD2Rを介するものであり、ROS産生の抑制とミトコンドリア活性を高めることによることが示されました。驚くべきことに、ROPIはこのアッセイ法では、ALSに対する承認薬であるリルゾールやエダラボンより治療効果が2〜3倍ほど高いことが分かりました(文献3)。
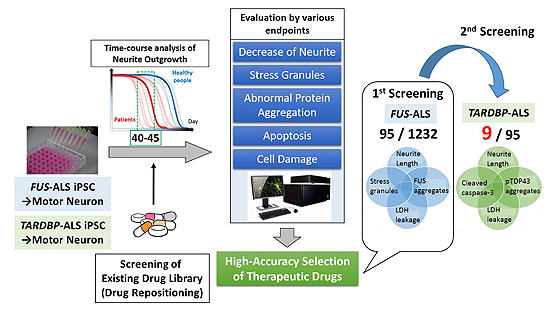
図2. 既存薬ライブラリーを用いたALS治療候補薬の同定
FUS変異およびTDP-43遺伝子変異を有するALS運動ニューロンを用いて、既存薬ライブラリーの1223化合物を図中に示したALS関連表現型を抑制する薬剤をスクリーニングし、9つの薬剤を選出した。この中から最も強い治療効果を示し、血液脳関門透過性があり、ALS 以外の神経疾患に対して承認されているROPIをALS治療候補薬として同定するに至った。
次に、From Rare to Commonのコンセプトに則り、孤発性のALS(sporadic ALS、以下SALS)への解析と治療法の開発の可能性を追求してみました。SALS患者さん32症例から誘導したiPS細胞由来運動ニューロンの解析を行い、ROPIはALS6 やALS10などのnon SOD1型のFALSのみならず、SALS症例の約7割にin vitroで運動ニューロンの変性抑制効果がありました。また、今回のスクリーニングで得られた9化合物の中で、ROPI がSALSの患者さんらからのiPS細胞由来運動ニューロンに対しても最も治療効果が高いことが分かりました。孤発性のALSでは、運動ニューロンにおいて、FUSあるいはTDP-43蓄積表現型を呈する群が、ROPIのresponderであり、いずれも蓄積しない群がNon responder群であることが予想されました。SALS患者由来の運動ニューロンの神経突起長の退縮からみた症状の進展のスピードや蓄積蛋白質の解析から、今まで分類不能であったSALSを分類し、in vitroでの治療効果を予測することが可能となりました(文献3)。
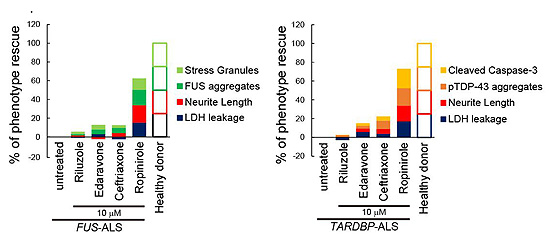
図3. ROPIの既存の既存の抗ALS薬に対する優位性
今回開発したアッセイ法では、ROPIの抗ALS効果(縦軸)は、ALS治療薬として承認されているリルゾールやエダラボンや臨床研究中のセフトリアキサゾンより強い。
(文献3より改変)
今後の展望
現在、慶應義塾大学医学部神経内科との全面的な連携体制のもと、ROPIを用いたALS(SALSおよびFALS)に対する医師主導治験を、慶應義塾大学病院にて2018年12月より開始するに至りました(治験責任医師:中原 仁教授)。また、治験に参加した患者さんからiPS細胞を樹立し、in vitroでの治療効果とin vivoの治療効果を比較するという探索的研究を行う計画であり、治療効果をより正確に予測・判定するために、より多くの確かなバイオマーカーを見出していくことが必要であると考えられます。
参考文献
- Establishment of in vitro FUS-associated familial amyotrophic lateral sclerosis model using human induced pluripotent stem cells.Ichiyanagi N, Fujimori K, Yano M, Ishihara-Fujisaki C, Sone T, Akiyama T, Okada Y, Akamatsu W, Matsumoto T, Ishikawa M, Nishimoto Y, Ishihara Y, Sakuma T, Yamamoto T, Tsuiji H, Suzuki N, Warita H, Aoki M, Okano H.
Stem Cell Reports, 2016 Apr 12;6(4):496-510. doi: 10.1016/j.stemcr.2016.02.011. - Escape from pluripotency via inhibition of TGF-β/BMP and activation of Wnt signaling accelerates differentiation and aging in hPSC progeny cells.
Fujimori K, Matsumoto T, Kisa F, Hattori N, Okano H and Akamatsu W.
Stem Cell Reports, 2017 Nov 14;9(5):1675-1691.
doi:10.1016/j.stemcr.2017.09.024. - Modeling sporadic ALS and identification of a potential therapeutic agent in iPSC-derived motor neurons.
Fujimori K, Ishikawa M, Otomo A, Atsuta N, Nakamura R, Akiyama T, Hadano S, Aoki M, Saya H, Sobue G, Okano H.
Nat Med, 2018. doi: 10.1038/s41591-018-0140-5.

左から、藤森康希 (現所属:大日本住友製薬株式会社)、岡野栄之 (生理学教室教授)
最終更新日:2018年12月4日
記事作成日:2018年11月1日