研究の背景
世界中で大規模な災害が起きるたびに筋挫滅症候群(Crush syndrome)による死傷者が多く発生します。米国内務省の統計を見ると世界中の巨大地震による死傷者数は増加の傾向にあります。これは、近年の世界的な人口増加・密集によって、以前と同程度の地震規模であっても被害が増大するためと考えられています。我が国でも1995年に発生した阪神淡路大震災において370人以上のCrush syndrome患者が発生し、そのうちの約50人が亡くなったとされています。一般的に筋組織の破壊は外傷以外にも薬剤性、虚血性等が知られており、いずれの場合でも骨格筋組織が破綻し血中へ漏れ出た筋由来成分が様々な臓器障害を引き起こすことが分かっており、これを横紋筋融解症と呼びます。主要臓器障害の中でも特に腎障害が深刻であると考えられており、急性腎障害(Acute kidney injury:AKI)を合併すると生命予後が悪化することが明らかになっています。ところが、現時点では横紋筋融解症に合併する腎障害を予防する方法は確立しておらず、疾患の発生メカニズムを解明することは新たな治療法を確立するために重要であると考えられています。
これまでに分かっていた横紋筋融解症による腎障害のメカニズムと我々の仮説
筋肉組織を構成している筋細胞の中には、筋組織に酸素を供給する役割を持つミオグロビン(myoglobin:Mb)と呼ばれる蛋白や電解質等が含まれています。外傷等がきっかけとなり筋組織が破壊されるとミオグロビンやそれに含まれるヘム蛋白(鉄イオンを内包する蛋白)や活性酸素種(Reactive oxygen species:以下、ROS)等が、一度に大量に血液の中に流入します。その結果、腎臓の尿細管といわれる部位に傷害が引き起こされます。そのメカニズムとしてミオグロビンそのものが尿細管細胞に毒性を発揮するという説や、ミオグロビンから遊離した鉄イオンやそれに引き続き過剰産生されたROSが尿細管細胞に傷害を与えるという説、酸化脂質の過剰産生が尿細管障害や閉塞を引き起こすという説、その他にも酸塩基平衡の破綻や電解質異常が腎毒性をもたらすという説などが提唱されてきました。特に最近の研究では、筋組織の破綻に引き続いて白血球細胞の一つであるマクロファージが活性化し、腎臓へ入り込んでくること(浸潤)が腎障害の一因となっていることが複数のグループにより明らかにされてきました。しかし、腎臓へ浸潤したマクロファージがどのようなメカニズムによって腎障害を起こすのかについては十分に解明されていませんでした。
本研究で我々が注目したのは、白血球細胞外トラップ(Leukocyte extracellular traps:以下、ETs)と呼ばれる現象です。古くから白血球は生体の外から侵入してきた微生物(細菌やウイルス等)を貪食や脱顆粒によって除去し、生体を防御するための細胞として知られてきました。2004年、新たな生体防御機構として好中球細胞外捕捉現象(neutrophil extracellular traps:以下、NETs)が報告されました。これは細菌感染等を契機として好中球が活性化され、種々の細胞内経路の活性化を経て最終的に自らのクロマチン線維(通常は核の中に収納されているDNAやヒストン等から成る構造物)を細胞外へ放出し、さらに一連のNETs形成過程で好中球自身は細胞死に至る(NETosis)という現象です。細胞外へ放出された網目状のクロマチン線維が細菌やウイルスを絡めとり、殺菌し、生体を外来微生物から防御します。ところがNETsに含まれるヒストンは細胞障害性を有しており、生体にとって有害となることが分かっています。さらにNETsの制御不全が様々な疾患の原因となっていることが数多く報告されています。2010年のChowらの報告を始めとし、その後も複数の研究グループによって同様の現象がマクロファージにも起こることが見出されました。外来微生物や特定の薬剤が刺激となって細胞内でROSの過剰産生が起こり、マクロファージからDNAが細胞外へ放出されます (macrophage extracellular traps:以下、METs)。NETsとMETsの間には両者ともROS依存性であるという共通点を有する一方、NETs誘導に必要とされているmyeloperoxidase (MPO)やelastaseなどのプロテアーゼ(蛋白質分解酵素)はマクロファージでは活性が低いことから、大きな相違がある現象と考えられます。このような背景から我々は、横紋筋融解症において腎臓に浸潤したマクロファージ由来の不適切なMETs産生が腎障害の一因になっているのではないかという着想に至り、METsと疾患メカニズムの関係について研究を開始しました(図1)。
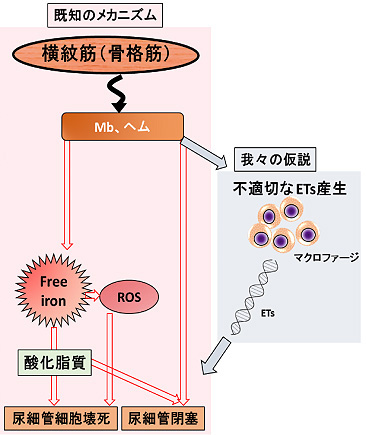
図1. マクロファージ由来のETsによる腎障害
新たに見出した腎障害のメカニズム
横紋筋融解症に続発する急性腎障害の動物モデルとして、グリセロールをマウスの骨格筋に筋肉内注射することで筋組織を破壊し腎障害を続発させる方法(Glycerol-induced rhabdomyolysis)を用いました。筋破壊から24時間後の腎機能(血中BUN及びCrの測定)および腎組織は高度に傷害されますが、METsの除去剤(DNase1)及び産生阻害剤(Cl-amidine:CLA)の投与下では、腎障害が軽減しました。METs産生にはヒストン修飾の一つであるシトルリン化が必須であり、このヒストンのシトルリン化を制御している酵素としてpeptidylarginine deiminase 4 (PAD4)が知られています。遺伝的にPAD4を欠損したマウスにおいても、野生型と比較し筋破壊後の腎障害は軽減されるという結果が得られました。これらの結果から、METs産生が横紋筋融解症に続発する腎障害の原因の一つとなっている可能性が考えられました。
これまでにETs放出の契機として細菌感染や自己抗体、活性化血小板等が知られています。そこで我々は横紋筋融解症続発性腎障害においてマクロファージがどのようなメカニズムでMETsを放出するのかについて、血中に流入したヘムとそれによって活性化した血小板(Heme-induced platelet activationとして知られている現象)とそのカウンターパートとしてマクロファージ上に発現しているMac-1(接着因子として知られるインテグリンファミリーの一つで別名CD11b/CD18)に注目しました。血小板を特異的抗体によって免疫学的に除去したマウス、Mac-1を遺伝的に除去したマウスでは筋破壊後の腎障害は軽減するという結果が得られました。重要なことにこれらのマウスでは、血中のMETsの指標である遊離dsDNA濃度もまた低下していました。また試験管内において、マクロファージと活性化血小板の共培養によりMETsが産生されることを見出しました。ヘムによって活性化された血小板との相互作用で惹起されたMETs産生がMac-1に依存しているという結果は、試験管内で得られた結果と合致していました。我々の研究室では過去にETs放出の抑制作用を持つ物質として、好中球の顆粒内蛋白の一つであるラクトフェリンを同定しましたが、横紋筋融解症惹起性腎障害に関しても試験管内及び生体内の実験においてETs抑制作用及び腎障害抑制作用を示しました。以上のように、我々は崩壊した筋由来の鉄含有蛋白であるヘム蛋白が血小板を活性化し、腎臓へ浸潤したマクロファージ表面のMac-1を介したMETs形成が尿細管障害を引き起こす、という新規の病態発生機構を見出しました(図2)。
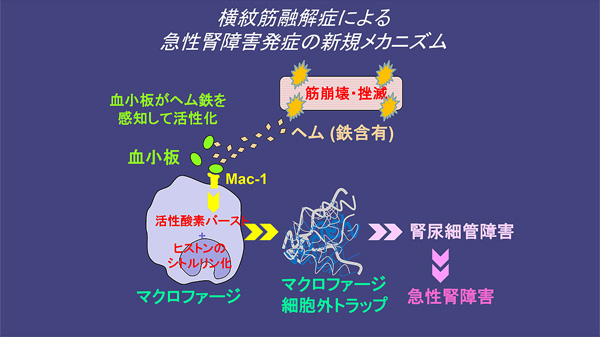
図2. 筋崩壊に続くMETs産生および腎障害発生の概要
今後の展望
横紋筋融解症惹起性腎障害に対して有効とされている治療は輸液、血液透析といった対症療法しかないのが現状です。しかもそれらの治療は供給及び輸送手段が限られた災害現場で速やかに実施することは困難であり、最寄りの医療機関への搬送を経るため治療の最適時期を逃してしまいます。そのため簡便に施行できる治療法の開発が急務と考えられます。上記のようなMETsを介在する腎障害の発生メカニズムを考えると、ETsを抑制する、というアプローチは新たな治療選択肢となり得ると我々は考えています。
参考文献
Macrophage extracellular trap formation promoted by platelet activation is a key mediator of rhabdomyolysis-induced acute kidney injury.
Okubo K, Kurosawa M, Kamiya M, Urano Y, Suzuki A, Yamamoto K, Hase K, Homma K, Sasaki J, Miyauchi H, Hoshino T, Hayashi M, Mayadas TN, Hirahashi J.
Nat Med. 2018 Feb;24(2):232-238. doi: 10.1038/nm.4462. Epub 2018 Jan 8.

前列左から2人目:平橋淳一(総合診療教育センター専任講師)、前列右から2人目:大久保光修(同助教)
稿を終えるにあたり、本研究に対し長年のご指導をいただきました藤田敏郎先生(前列中央)に深謝いたします。
最終更新日:2018年8月1日
記事作成日:2018年8月1日