研究の背景
心臓病は全世界で死因の上位を占める病気です。心筋梗塞や拡張型心筋症などの心臓病は正常な心筋細胞を失い、その部分は線維化(線維芽細胞)によって置き換えられるため、心臓のポンプ機能は低下します。iPS細胞などの多能性幹細胞は、このような心臓病に対する再生医療の1つの手段として期待されています。しかしながら、iPS細胞の腫瘍化や、大量の細胞移植に必要なコストの問題など課題もあります。
私たちは新しい心臓再生法として、心筋特異的な3つの遺伝子(心筋誘導遺伝子(注1)Gata4, Mef2c, Tbx5)を心臓線維芽細胞(注2)に導入することで、iPS細胞を経由せずに心筋細胞を作製することに世界で初めて成功しました(文献1)。その後、私たちあるいは海外の研究室から、遺伝子の追加や細胞培養条件により心筋細胞の誘導効率が改善することが報告されました。また、マウスの心筋梗塞モデルで、Gata4, Mef2c, Tbx5遺伝子を直接心筋梗塞部位に導入することによって、生体内においても線維芽細胞から直接心筋細胞を作製できることが報告されました(図1)。
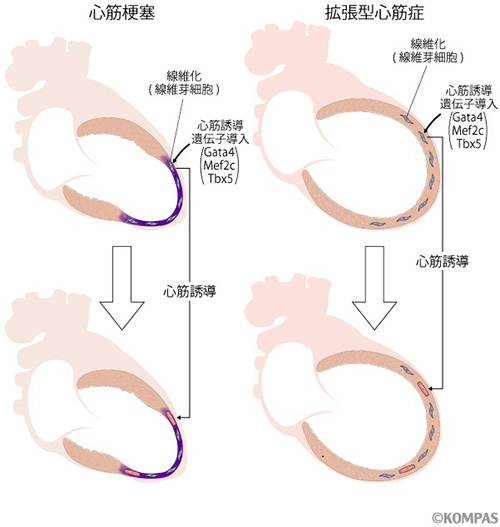
図1.心臓線維芽細胞を心筋細胞に誘導して心臓再生
しかし、これまでの研究では心筋誘導遺伝子がどのタイミングで有効に働いているのか不明であり、また心筋誘導の分子機序はよく分かっていませんでした。さらに、これまでの心筋誘導ではレトロウイルスベクター(注3)が使用されていましたが、この方法では心筋誘導効率が低く、またゲノムに心筋誘導遺伝子が組み込まれるため安全面で課題がありました。そこで私たちはこれらの課題を解決するため下記の研究を行いました。
新しい遺伝子発現システムの開発と心筋誘導メカニズムの解明
今回私たちは、心筋誘導遺伝子の発現調節を従来法に比べて簡便化するシステムの開発に成功しました。従来のドキシサイクリン(テトラサイクリンの誘導体)を用いた遺伝子発現システムは、テトラサイクリン依存性転写調節因子(rtTA:reverse tetracycline transactivator)とテトラサイクリン応答因子(TRE:tetracycline response element)を含む2つのウイルスベクターを同時に感染させる必要があり工程が煩雑でした。またこの方法ではウイルスベクターの感染効率は約60%と低く、心筋細胞の誘導効率が低いという問題点がありました。そこで、この問題を解決するため、私たちはrtTAとTREをどちらも含むウイルスベクターを開発し、これによって1つのベクターのみでドキシサイクリンによる遺伝子発現調節ができ、工程が簡便になりました。また遺伝子の導入効率はほぼ100%と改善し、心筋細胞の誘導効率は約3倍改善しました。次に、この新しい遺伝子発現システムを用いて、Hand2遺伝子が心筋誘導のどのタイミングで必要か、また心筋誘導の分子機序を解析しました。その結果、Hand2の発現は心筋誘導の初期のみ(心筋誘導開始後2週間)に重要であり、3週目以降の後期には必要がないことを明らかにしました。さらにHand2はmycやサイクリンなどの細胞周期関連遺伝子の発現を抑制し、細胞増殖を抑制することで心筋誘導を促進することが分かりました(文献2)。本研究により、これまで明らかでなかった心筋誘導に必要な遺伝子発現期間やその分子メカニズムの一端を解明しました(図2 上図)。
センダイウイルスベクターを用いた安全かつ効率的な心筋誘導と心臓再生への応用
さらに私たちは、遺伝子がゲノムに組み込まれない、安全性の高い心筋誘導センダイウイルスベクター(注4)を開発しました。従来法のレトロウイルスベクターを用いた心筋細胞の誘導では、拍動する心筋細胞の作成効率は約0.1%であり、作製までに約1ヶ月がかかりました。一方で、センダイウイルスベクターを用いた新しい方法では、拍動する心筋細胞の作成効率は約10%と、これまでの100倍に改善し、約10日間という短期間で心筋を作製することに成功しました。また、マウスの心筋梗塞モデルを用いて、心筋誘導遺伝子を直接心筋梗塞部位に導入すると、これまでのレトロウイルスベクターでは誘導効率は約1%でしたが、センダイウイルスベクターでは約5%と上昇し、生体内でも心筋細胞の誘導効率が約5倍改善しました。さらに、センダイウイルスベクターによる治療を行った群は、治療していない群と比較して1ヶ月後の心臓のポンプ機能は改善し、心筋梗塞後の梗塞面積は約半分に縮小しました(図2下図)。以上より、この新しい心筋誘導センダイウイルスベクターにより、安全かつ効率的な心筋細胞の誘導に成功し、マウス心筋梗塞で心臓再生と心機能の改善を確認できました(文献3)。
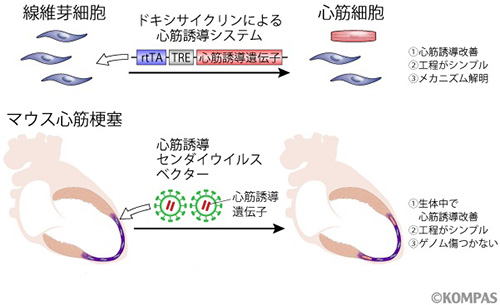
図2.新しい遺伝子発現ベクターによる心筋誘導と心臓再生
まとめ
今回私たちは、新しい遺伝子発現システムを開発することで、心筋誘導効率の改善、分子メカニズムの解明やマウス心臓再生に成功しました。これらの研究成果は、細胞移植を必要としない、簡便で体に負担の少ない、新しい心臓再生医療実現を前進させる大きな一歩であると考えます。
【用語解説】
(注1)心筋誘導遺伝子
家田らが発見した心筋細胞を直接作製するために必要な3つの遺伝子群(Gata,Mef2c,Tbx5)や、ヒト心筋細胞を直接作製する5遺伝子(Gata4,Mef2c,Tbx5,Myocd,Mesp1)あるいは6遺伝子(5遺伝子+miR-133)で、iPS細胞を樹立する時の「山中ファクター」にあたる。
これら遺伝子群を線維芽細胞に導入すると、iPS細胞を経ることなく心筋細胞を直接作製できる。
(注2)心臓線維芽細胞
心臓内結合組織を構成する細胞で、細胞外基質、液性因子を分泌する。心筋梗塞や拡張型心筋症などの病態では、心筋細胞数の減少に伴い心臓線維芽細胞が増殖し、心臓ポンプ機能障害や心臓線維化が起きる。
(注3)レトロウイルスベクター
ベクターとは、細胞外から内部へ遺伝子を導入する際の「運び屋」を指す。目的遺伝子をウィルスに組み込み、細胞に感染させることにより遺伝子を導入する。レトロウイルスベクターは、このウイルスベクターの1種類として確立されたもので、宿主の細胞に感染した後、宿主のゲノム(DNA)の中に入り込み遺伝子を発現する。
(注4)センダイウイルスベクター
センダイウイルスベクターは、ウイルスベクターの1種類として確立され、宿主の細胞に感染した後、宿主のゲノム(DNA)に入り込むことなく、細胞質内で遺伝子を発現し細胞のゲノムを損傷することがない。これまでに「山中ファクター」を発現するセンダイウイルスベクターが開発されており、細胞のゲノムを損傷することなく、効率よく短期間でiPS細胞を作成できることが知られている。
参考文献
1. Direct reprogramming of fibroblasts into functional cardiomyocytes by defined factors.
Ieda M, Fu JD, Delgado-Olguin P, Vedantham V, Hayashi Y, Bruneau BG, Srivastava D.
Cell. 2010 Aug 6;142(3):375-86. doi: 10.1016/j.cell.2010.07.002.
2. Single-Construct Polycistronic Doxycycline-Inducible Vectors Improve Direct Cardiac Reprogramming and Can Be Used to Identify the Critical Timing of Transgene Expression.
Umei TC, Yamakawa H, Muraoka N, Sadahiro T, Isomi M, Haginiwa S, Kojima H, Kurotsu S, Tamura F, Osakabe R, Tani H, Nara K, Miyoshi H, Fukuda K, Ieda M.
Int J Mol Sci. 2017;18(8). pii: E1805. doi: 10.3390/ijms18081805.
3. Direct In Vivo Reprogramming with Sendai Virus Vectors Improves Cardiac Function after Myocardial Infarction.
Miyamoto K, Akiyama M, Tamura F, Isomi M, Yamakawa H, Sadahiro T, Muraoka N, Kojima H, Haginiwa S, Kurotsu S, Tani H, Wang L, Qian L, Inoue M, Ide Y, Kurokawa J, Yamamoto T, Seki T, Aeba R, Yamagishi H, Fukuda K, Ieda M.
Cell Stem Cell. 2018;22(1):91-103. doi: 10.1016/j.stem.2017.11.010.

右:梅井智彦(現所属:東京医療センター循環器内科)、左:家田真樹(現所属:筑波大学医学医療系循環器内科学教授)
最終更新日:2018年4月4日
記事作成日:2018年4月4日