はじめに
現在、日本の65歳以上の高齢者の人口割合は25%を超え、男女共に4人に1人は高齢者という超高齢社会に突入しています。今後もこの状況が持続することが予測されている今、高齢者への医療費や介護費用の高騰が危惧されています。年齢の積み重ねという意味での加齢は生きている限り止められませんが、肉体的な老化を抑制することは、高齢でも健康を維持し、社会でも活躍できる可能性を担保する上でも意味があることと考えられます。
老化のメカニズム
老化の制御というのは、古来より人類の夢でした。しかし、老化の仕組みが分からないと、老化をコントロールするための薬は作れません。そこで我々の研究チームは、まずこの老化の仕組みを分子の言葉で説明すること、つまり分子メカニズムを解明することを試みました。リンは生体の恒常性を保つ上で大切な働きを持つミネラルですが、過剰に摂取すると老化を促進してしまいます。そこで、我々はこのリン代謝を制御する分子であるEctonucleotide pyrophosphatase/phosphodiesterase 1 (Enpp1)(注1)という膜貫通型タンパク質に注目し、その自然変異によりEnpp1の機能を喪失した変異マウスであるEnpp1欠損マウスの解析を行うことにしました。
Enpp1欠損マウスにリンを余分に投与する解析を行ったところ、急激に老化が進み、短命になってしまうことが明らかになりました。この時、リンを投与されたEnpp1欠損マウスでは腎臓で老化制御因子として有名なKlotho(注2)という遺伝子の発現が顕著に低下することが分かりました。つまり、過剰なリンの摂取時には、Enpp1はKlothoの発現を維持することで、老化が進まないようにしていたことを明らかにすることができました。不老不死の薬などはまだ夢物語ですが、将来的には、今回の発見が何らかのヒントになればと思っているところです。
我々の解析から見える老化のメカニズム
今回我々は、Enpp1を欠損したマウスを用いて、過剰な摂取により老化が進むことが知られるリンを投与することにしました。通常の食事の1.5〜2倍程度のリンを含む食事を与えると、野生型マウスでは何ともないのですが、Enpp1欠損マウスではリン投与後3週間程度で致死となってしまうことが分かりました。リンを多く摂取したEnpp1欠損マウスでは、大動脈や腎臓の石灰化、骨粗鬆症の進行、皮膚の萎縮など、人間の老化と同じ老化が起こっており、つまり寿命の短縮は急激な老化によるものであることが明らかになりました(図1)。これらの老化の表現型は老化モデルマウスとして知られるKlothoマウス(Klothoの発現抑制マウス)と全く同じものでした。
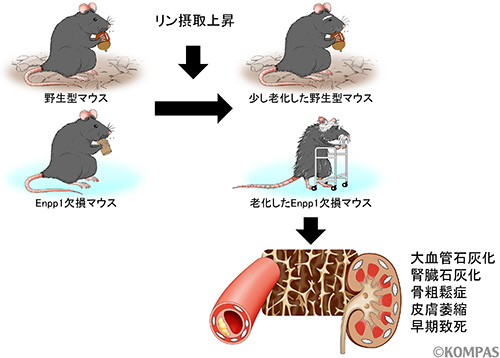
図1.Enpp1はリン摂取時の老化を抑制する
通常(野生型マウス)でも、リンを多く摂取しただけで少し老化が進みやすくなります。ところがEnpp1遺伝子に変異があると、それが加速し、様々な臓器に老化症状がでます。
Klothoは腎臓において活性型ビタミンD合成酵素であるCyp27b1の発現を抑制する働きを担っています。Klothoの発現が抑制されると、Cyp27b1の発現を抑制できずCyp27b1の発現の上昇から血中の活性型ビタミンDである1,25(OH)2D3の濃度が上昇することになります(図2)。Klothoの発現制御機構については様々な解析がなされてきましたが、Klothoマウスのような老化症状を呈するようなマウスは発見されていませんでした。今回、リンを多く摂取したEnpp1欠損マウスでは腎臓のKlothoの発現が顕著に低下していたことから、リン存在下にはEnpp1がKlothoの発現を維持するのに必須の役割を担うことが分かりました(図2)。
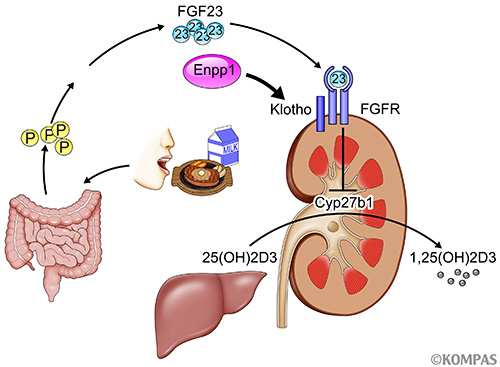
図2.リン濃度の調節
食事で摂取されたリンは小腸で吸収されます。腸で吸収されたリンは骨からのFGF23の分泌を刺激します。骨から分泌されたFGF23はホルモンとして腎臓に到達し、FGF受容体(FGFR)とKlothoの共受容体を刺激して、活性型ビタミンD受容体である1,25(OH)2D3の合成酵素であるCyp27b1の発現を抑制します。1,25(OH)2D3は腸管からのリンの吸収をあげるので、Cyp27b1の発現を抑制すると1,25(OH)2D3の低下から腸管でのリンの吸収が低下します。この時、Enpp1はKlothoの発現を維持するのに必須の役割を果たすので、Enpp1の機能不全ではKlothoの発現を維持できず、FGF23からのnegative feedbackがきかず、Cyp27b1と1,25(OH)2D3が高いままになり、様々な症状を呈することになります。
Klothoの発現が抑制されると、血中の1,25(OH)2D3の濃度が上昇しますが、リンを多く摂取したEnpp1欠損マウスでも同様に血中の1,25(OH)2D3の濃度が上昇していました。Enpp1欠損マウスからビタミンD受容体を欠損させたマウスでは、リンを多く摂取しても寿命の短縮や大動脈の石灰化などを完全にブロックすることができました。つまり、リン-Enpp1-Klotho-Cyp27b1-1,25(OH)2D3の経路のどこかに障害があると老化が進んでしまうことが明らかになりました。
まとめと今後の展望
今回、老化の仕組みの一部を明らかにすることができました。若返りをさせることはできませんが、少なくとも老化を遅らせることはできるようになるかもしれません。また、Enpp1遺伝子変異は、その遺伝子の変異の違いによっては低リン性くる病(Autosomal recessive hypophosphatemic rickets type 2 :ARHR2)や乳児期に心血管系の石灰化などから極めて高い確率で致死に至るGeneralized Arterial Calcification of Infancy (GACI)、また椎体の後面を上下に連結する後縦靭帯が骨化してしまう難病の後縦靭帯骨化症(ossification of the posterior longitudinal ligament, OPLL)など、様々な疾患の原因になることが明らかになっています。低リン性くる病はEnpp1以外の遺伝子変異でも起こることが知られており、現在の治療はリンやビタミンDの投与ですので、同じ低リン性くる病でもその原因となっている遺伝子がEnpp1の場合はリンやビタミンDを投与するとかえって症状を悪くしかねない可能性があります。GACIやOPLLは現在のところ有効な治療法が見つかっていません。今回の発見は、これらの疾患の治療にも応用できるものになる可能性があります(図3)。
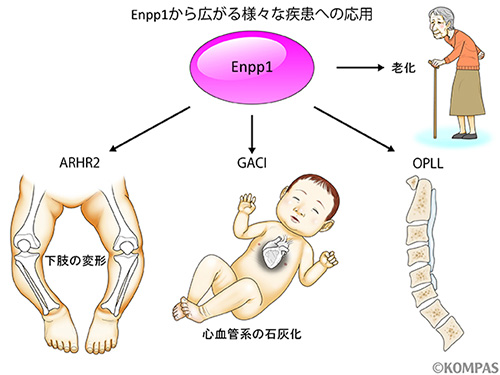
図3.Enpp1からの疾患への応用
Enpp1は老化以外に様々な疾患に関与することが知られています。低リン性くる病の1つであるARHR2や乳幼児期に心血管系の石灰化等で致死率が高いGACI、後縦靭帯が骨化する難病のOPLLなど、今回の発見がこれらの疾患の治療にも応用できることを期待しています。
【用語解説】
(注1)Ectonucleotide pyrophosphatase/phosphodiesterase 1 (Enpp1)
1回膜貫通型タンパク質。変異により、低リン性くる病や後縦靭帯骨化症の原因になることが知られている。
(注2)Klotho
1回膜貫通型と可溶型のタンパク質。リン代謝および老化を制御することが知られている。
参考文献
Enpp1 is an anti-aging factor that regulates Klotho under phosphate overload conditions.
Watanabe R, Fujita N, Sato Y, Kobayashi T, Morita M, Oike T, Miyamoto K, Kuro-O M, Michigami T, Fukumoto S, Tsuji T, Toyama Y, Nakamura M, Matsumoto M, Miyamoto T.
Sci Rep. 2017 Aug 10;7(1):7786. doi: 10.1038/s41598-017-07341-2.

筆者
最終更新日:2018年2月1日
記事作成日:2018年2月1日