細胞周期・チェックポイントとがん
私たちの体を形作るあらゆる細胞は、増殖、分化、あるいは細胞死の機構が適切に働くことで、特定の臓器・組織を正しく構築するための秩序を保っています。一方で、ひとたびこれらの組織構築の秩序が乱されると、がんや奇形、萎縮などの異常が起きます。
細胞周期とは、一つの細胞が分裂して二つの娘細胞に増える過程をいい、上記の組織構築の秩序を保つための重要な制御システムの一つです。細胞周期(図1)には4つのステップ、すなわちDNAの複製を行うS期、細胞分裂を行うM期に加え、それぞれの準備期間であるG1とG2期があります。各ステップで、DNA配列や染色体の異常がある場合に細胞周期をストップさせる「チェックポイント」と呼ばれる機構が存在します。
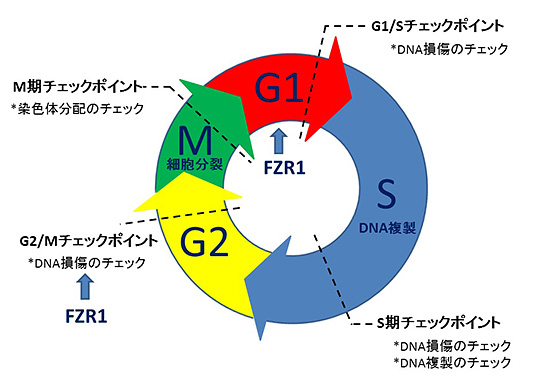
図1.細胞周期・チェックポイント
ほとんど全てのがんでは、細胞周期やチェックポイントの制御システムに異常(特に細胞周期の過剰な活性化やチェックポイントの不具合)が起きており、つまりは細胞周期の異常ががん細胞の特性をサポートしていることが知られています。しかし一方で、それらの異常が、がんの発生や進展に具体的にどう影響しているかは解明されていません。私たちは、そのような基本的で重要な命題に挑むために、MDアンダーソンがんセンターと7年越しの共同研究を行い、下記のような大変興味深い結果を報告することができました。
細胞周期制御分子FZR1の欠失は白血病細胞にとって諸刃の剣となる
私たちが着目した分子FZR1は、細胞周期のうちG1期を持続させるのに不可欠であり、加えて、G2/M期におけるDNA損傷のチェックと修復を行う機構(G2/Mチェックポイント)に重要な役割を果たすことが知られています。がん細胞におけるFZR1の役割についてはこれまでもいくつかの報告がありましたが、FZR1ががんの発生・維持に対して促進的に働くのかあるいは抑制的に働くのかという重要なことが不明でした。というのも、多くのがん組織においてFZR1の発現量が低下していること、FZR1遺伝子の欠失が腫瘍発生を促すといった報告がある一方で、FZR1遺伝子の欠失が細胞死を引き起こすとする一見逆説的な報告もあったためです。また、FZR1遺伝子を欠失させた血液細胞では、特定のストレス(放射線照射によるDNA損傷)に対する脆弱性が増すものの、それだけで悪性腫瘍発生には至らないという研究結果を、私たちは以前に報告しています。
そこで今回私たちは、成人B細胞性急性リンパ性白血病(B-ALL)のマウスモデルを用い、FZR1を欠失させることで、白血病が時系列でどのような影響を受けるのかを詳細に解析しました。興味深いことに、FZR1が正常な場合に比較して、FZR1を欠失させた場合にはB-ALLマウスの生命予後が改善することがわかりました。更に、これらのマウスの病変組織の病理学的観察やマイクロアレイ、またB-ALL細胞株を用いた検証実験などを通じて詳細に解析したところ、B-ALLマウスの生命予後が改善した理由として、FZR1欠失により抗がん剤やDNA損傷ストレスに対するB-ALL細胞の感受性が増すことがわかりました。これは、FZR1欠失によりがん細胞におけるDNA損傷が修復されづらくなり、それらの損傷を患った細胞が細胞死によって淘汰されるためでした。それを裏付けるように、約200症例のB-ALL患者さんから得られたタンパク質検体と臨床データの解析により、治療前のFZR1が少ないほど初期治療に反応しやすく、無病状態を長期に保てる傾向にあることが判明しました(図2)。
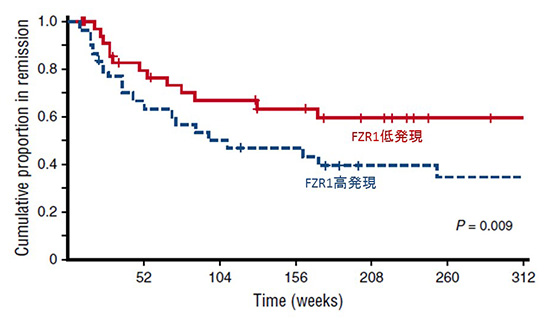
図2.B-ALL患者由来の白血病細胞のタンパクアレイ及び臨床データを用いた解析 (寛解維持期間)
B-ALL初発例において、FZR1低発現症例では、化学療法後の寛解維持期間が有意に長期であった。
(参考文献のFigure 4Bより一部改変)
しかし一方で、重要なこととして、長期のFZR1欠失は逆にB-ALLの悪性度を高める危険性を伴うこともわかりました。というのも、マウスに発生した白血病細胞を正常なマウスに改めて移植(二次移植)し、二次移植で発生した白血病細胞をさらに別の正常なマウスに移植(三次移植)すると、二次移植・三次移植によりB-ALLを発症したマウスでは、FZR1を欠失させた場合にこそ悪性度の高い治療抵抗性のB-ALLを発症し、生命予後が短くなりました(図3)。
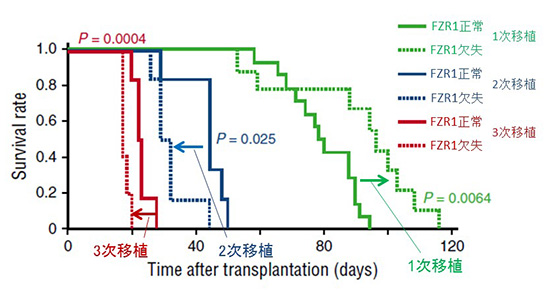
図3.B-ALLマウスモデルでのFZR1の有無による生存曲線の比較
FZR1欠失群では正常群に比して、1次移植においては生存が延長(DNA損傷ストレスに対してより脆弱化)し、2次・3次移植においては逆に生存が短縮された(DNA損傷ストレスに対して抵抗性を獲得)。
(参考文献のFigure 5Aより一部改変)
本研究結果の臨床的意義
上記の通り、一見相反する結果は、FZR1欠失が白血病細胞にとって「初期には治療感受性を高め、長期的には悪性度を高める」というように経時的にその意義が逆転することを明らかにしました。本研究は、抗がん剤感受性を予測できる因子の可能性を提示したと同時に、近年がん領域での開発が有望視されているDNA修復分子阻害薬の意義とリスクを提言しています。また、本研究結果は「DNA修復機能が低下したがん細胞は後々に治療抵抗性獲得を助長するリスクがあるため、治療初期に根絶することが肝要である」ことを意味し、今後のがん治療デザインに一つの方向性を示唆しています。
参考文献
FZR1 loss increases sensitivity to DNA damage and consequently promotes murine and human B-cell acute leukemia.
Ishizawa J, Sugihara E, Kuninaka S, Mogushi K, Kojima K, Benton CB, Zhao R, Chachad D, Hashimoto N, Jacamo RO, Qiu Y, Yoo SY, Okamoto S, Andreeff M, Kornblau SM, Saya H.
Blood. 2017 Apr 6;129(14):1958-1968. doi: 10.1182/blood-2016-07-726216.

写真左:石澤丈(現所属:テキサス大学MDアンダーソンがんセンター白血病科インストラクター)
写真右:(左から)杉原英志(先端医科学研究所特任助教)、佐谷秀行(同研究所教授)
最終更新日:2017年11月1日
記事作成日:2017年11月1日