脳梗塞とは
脳卒中は、脳の血管が詰まる、もしくは切れることによって起こる疾患で、わが国では死因の第3位、寝たきりの原因の第1位となる疾患です。脳梗塞は、脳卒中の1つで、血管が狭くなったり詰まったりすることで脳へ酸素とエネルギーが十分に供給されないことで障害が起こるもので、脳卒中の約7割を占めています。脳梗塞は脳細胞が壊死しており、MRIという画像検査で梗塞巣(脳神経細胞が死んでしまった部分)を確認することができます。発症数時間以内に血栓を溶かす薬を投与する以外には、脳梗塞に対する治療法は極めて少ないのが現状です。梗塞後は脳組織の壊死に伴って炎症が惹き起こされ、これも病態の悪化に関連していることが知られています。私たちはこれをマウスの脳梗塞モデルを使って証明してきました(文献1-4)。今回は、脳梗塞後の炎症を収束させるメカニズムに焦点をあてて研究を行いました。
脳梗塞後の炎症のプロセス
虚血によって脳組織が壊死に陥ると、1~3日という早期にマクロファージや好中球などの炎症細胞が脳内に浸潤します。特にマクロファージは、IL-1βやTNF-αなどの炎症性サイトカインを産生して炎症を促進します。壊死した臓器から様々な死細胞由来の成分が放出され、マクロファージ上のToll-like receptor (TLR)と呼ばれる微生物センサーを活性化します。これらはダメージ関連分子パターン(damage-associated molecular patterns: DAMPs)(注1)と呼ばれており、脳由来の物質としてはhigh mobility group box 1 (HMGB1)、heat shock protein、β-アミロイドなどがあります。私たちはマウス脳の抽出液より新たなDAMPsとしてペルオキシロドキシンファミリータンパクを見出しました。
マクロファージに続いて、梗塞発症3日目をピークにリンパ球が浸潤してきます。ヒトにおいてもT細胞の重要性は、T細胞の遊走を抑制する免疫抑制剤が脳梗塞体積や運動障害を減少させることから確かめられています(文献5)。特に、T細胞のうちでIL-17と呼ばれる炎症性サイトカインを放出するγδT細胞が、梗塞後の炎症に重要であることがわかっています。γδT細胞はマクロファージから産生されるIL-1βやIL-23によって刺激を受けるとIL-17を産生します。これらの結果より、脳損傷-->マクロファージ-->IL-1β、IL-23-->γδT細胞-->IL-17という脳梗塞後の炎症スキームが明らかにされました(図1)。
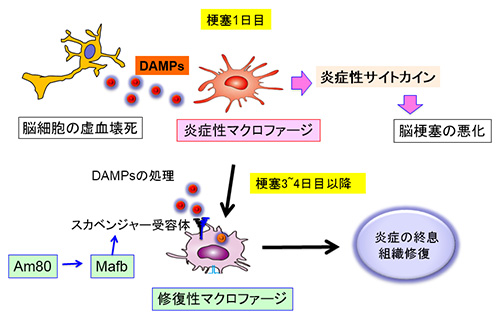
図1.脳梗塞後の炎症スキーム
発症直後にDAMPsが放出され、浸潤マクロファージを活性化し、炎症性サイトカインを産生させる。一方、発症3日目以降になると、浸潤マクロファージは修復型に変化してゆき、スカベンジャー受容体や修復因子を発現するようになり、DAMPs除去や組織修復に働くようになる。
脳梗塞後炎症の収束
一方で、梗塞発症4日目を過ぎるとペルオキシレドキシンやHMGB1などのDAMPsはマクロファージにより急速に細胞内に取り込まれて、リソゾームによって分解されます。このように、DAMPsが分解されてなくなることが炎症の収束に重要であると考えられます。そこで私たちは、マクロファージにペルオキシレドキシンやHMGB1に特異的な受容体が存在すると考えて、その遺伝子のクローニングを行ないました。方法としては蛍光標識されたDAMPsを取り込めなくなった変異マクロファージを単離して、もとのマクロファージと比べて発現していない遺伝子を取り出す、それらをひとつずつ変異マクロファージに戻して取り込みが回復する遺伝子を同定する、というものです。大変根気のいるやりかたですが、私たちはタイプAスカベンジャー受容体と呼ばれるMsr1やMarcoがDAMPsの取り込みに重要な受容体であることを見つけました。さらに転写因子としてMafbも単離されました。Msr1遺伝子のプロモーター領域の解析からMafbがMsr1の転写を引き起こすことがわかりました。Msr1/Marco欠損マウス、およびマクロファージ特異的Mafb欠損マウスを用いて脳梗塞モデルを行なったところ、これらのマウスでは通常3~4日で消失するはずのDAMPsが4日目以降も残存ししていました。その結果炎症性サイトカインの発現も低くならず、梗塞体積の増大や神経症状の悪化が認められました。すなわちMafbによるスカベンジャー受容体の発現誘導がDAMPsをクリアランスすることで炎症を収束させる重要なメカニズムであることが明らかとなりました。
梗塞組織の炎症収束と修復を利用した治療
さらに脳に浸潤するマクロファージを経時的に解析したところ、浸潤直後の1日目ではMsr1の発現は低いがその後日を追うごとに発現が増加しDAMPsの取り込み能が増加することがわかりました。同時にMsr1の発現の低いマクロファージはIL-1βやIL-23などの炎症性の因子を強く発現し、一方でMsr1の発現の高いマクロファージは炎症性サイトカインの発現は低く逆にIGF-I(注2)などの組織や神経の修復に働くと思われる因子の発現が高いことがわかりました。したがって、炎症の中心であるマクロファージは脳梗塞発症直後の1日目は炎症を促進するタイプ(いわゆるM1タイプ)であり、それが脳内で数日経つと炎症収束と神経修復に働く修復生マクロファージ(いわゆるM2タイプ)に転換することが明らかになりました。炎症性から修復性への転換の分子機構については今のところ完全にはわかっていませんが、このようなマクロファージの転換を早めれば脳梗塞の症状を軽減できる可能性があります。Mafbの発現はレチノイン酸受容体で活性化されることが知られています。そこで私たちはレチノイン酸受容体を活性化する薬剤であるAm80(タミバロテン)(注3)を試してみました。Am80は白血病治療薬としてすでに臨床で使われています。期待通りAm80は浸潤マクロファージ上のMsr1の発現を促進させ、脳梗塞後の炎症の抑制と梗塞体積の減少が認められました。神経症状も改善しました。
今後の展望
以上のことから脳梗塞後に浸潤したマクロファージの一部はスカベンジャー受容体を高発現し、DAMPsのクリアランスに働く修復性のマクロファージとなり、これらが炎症の終息と組織修復に重要な役割を果たすことがわかりました。次はMafbの発現を誘導する脳内因子の同定やマクロファージをM1型からM2型へ転換させる分子機構の解明が今後の課題です。これらの機構が解明されれば、マクロファージを炎症性から修復性に転換させる新たな脳梗塞治療法につながると考えられます。
【用語解説】
(注1)DAMPs
組織傷害に伴って細胞から放出され、周囲の組織や細胞に危険を知らせるアラームのような役割を担う因子のこと。脳梗塞においてはHMGB1やペルオキシレドキシン、S100A8/A9などがDAMPsとして機能することが知られている。
(注2)IGF-I
インスリン様成長因子1(IGF-1)はインスリンに構造的に似ている分子でインスリンに似た作用を有する他、多くの細胞に作用して増殖や生存を助ける。神経細胞の再生促進効果もある。
(注3)Am80
タミバロテン(Tamibarotene)は開発コードAm80の化合物名。別名、レチノ安息香酸とも呼ばれる合成レチノイドであり、急性前骨髄球性白血病(APL)に対する化学療法剤として用いられる経口剤。商品名アムノレイク。レチノインイン酸受容体RARを活性化するアゴニストとして知られている。
参考文献
MAFB prevents excess inflammation after ischemic stroke by accelerating clearance of damage signals through MSR1.
Shichita T, Ito M, Morita R, Komai K, Noguchi Y, Ooboshi H, Koshida R, Takahashi S, Kodama T, Yoshimura A.
Nat Med. 2017 Jun;23(6):723-732. doi: 10.1038/nm.4312. Epub 2017 Apr 10.
【本研究に先行する参考文献】
文献1. | Shichita, T., Sugiyama, Y., Ooboshi, H., Sugimori, H., Nakagawa, R., Takada, I., Iwaki, T., Okada, Y., Iida, M., Cua, D. J., Iwakura, Y., and Yoshimura, A. 2009. Pivotal role of cerebral interleukin-17-producing gammadeltaT cells in the delayed phase of ischemic brain injury. Nature medicine 15:946. |
文献2. | Shichita, T., Sakaguchi, R., Suzuki, M., and Yoshimura, A. 2012. Post-ischemic inflammation in the brain. Frontiers in immunology 3:132. |
文献3. | Ito, M., Shichita, T., Okada, M., Komine, R., Noguchi, Y., Yoshimura, A., and Morita, R. 2015. Bruton's tyrosine kinase is essential for NLRP3 inflammasome activation and contributes to ischaemic brain injury. Nat Commun 6. |
文献4. | Shichita, T., Hasegawa, E., Kimura, A., Morita, R., Sakaguchi, R., Takada, I., Sekiya, T., Ooboshi, H., Kitazono, T., Yanagawa, T., Ishii, T., Takahashi, H., Mori, S., Nishibori, M., Kuroda, K., Akira, S., Miyake, K., and Yoshimura, A. 2012. Peroxiredoxin family proteins are key initiators of post-ischemic inflammation in the brain. Nature medicine 18:911. |
文献5. | Fu, Y., Zhang, N., Ren, L., Yan, Y., Sun, N., Li, Y. J., Han, W., Xue, R., Liu, Q., Hao, J., Yu, C., and Shi, F. D. 2014. Impact of an immune modulator fingolimod on acute ischemic stroke. Proceedings of the National Academy of Sciences of the United States of America 111:18315 |

七田崇(現所属:東京都医学総合研究所)

左:七田崇、右:吉村昭彦(微生物学・免疫学教室教授)
最終更新日:2017年10月1日
記事作成日:2017年10月1日