はじめに
肺がんは我が国のがん死因の上位に位置し、根治治療が難しい病気です。この病気を克服するために様々な抗がん剤が開発されてきました。肺がんの原因として喫煙が有名ですが、喫煙者でない方でも肺がんを発症する場合があります。そのような患者さんでは特定の遺伝子の変異(異常)が肺がんの原因となることがあり、特にEGFR(Epidermal Growth Factor Receptor, 上皮成長因子受容体)遺伝子の変異が多く見つかります。肺がんの中でも非小細胞肺がんというタイプでは約30~40%程度の患者さんで、このEGFR遺伝子変異が見つかります。遺伝子変異を持つ患者さんでは分子標的薬が使用可能となり劇的な腫瘍縮小効果が得られます。しかし、分子標的薬の効果は永遠に続くわけではなく、多くの場合1年程度で耐性化し、効果が見られなくなってしまいます。これまでに様々な耐性化の仕組みが報告されていますが、今回私たちは新しい分子標的薬である第三世代EGFRチロシンキナーゼ阻害剤(EGFR-TKI)という薬に対する耐性化の仕組みの一部を解明することができました。
EGFR(上皮成長因子受容体)とは
EGFRは肺がん細胞の表面にあるタンパク質の一種で、上皮成長因子という分子が結合することで細胞に生存や増殖のシグナル(信号)を送ります。EGFRは正常な細胞でも発現していて、その生存シグナルの強さは上皮成長因子により適度に調整されています。しかし、EGFRタンパクの設計図であるEGFR遺伝子に変異があると、異常な変異型EGFRタンパクが作られ、上皮成長因子がない状態でも常にシグナルを送り続けてしまうようになります。その結果、細胞は無秩序に増殖し、がん化してしまいます。
EGFR-TKIはEGFRのシグナル伝達に重要な活性化部位であるチロシンキナーゼという分子を標的として阻害するため「分子標的薬」と呼ばれます。これまでに第一世代EGFR-TKIとしてイレッサ®(ゲフィチニブ)、タルセバ®(エルロチニブ)、第二世代EGFR-TKIとしてジオトリフ®(アファチニブ)という薬が開発され実際に患者さんが使用しています。しかし、これらを使用している患者さんの約半数で「T790M変異」という新たな(二次的な)EGFR遺伝子変異が生じ、1年程度で薬の効果が見られなくなってしまいます。これはT790M変異が生じることでEGFRタンパクの構造が変化し、薬がEGFRに結合できなくなってしまうためです。
そこで、T790M変異があるEGFRでも結合できるように設計され、開発されたのが第三世代EGFR-TKIです。第一世代、第二世代は変異型EGFRに強力に結合しますが、正常な組織に存在する変異のないEGFR(野生型EGFRと呼びます)にも作用してしまいます。そのため、野生型EGFRが多く発現している腸管や皮膚に障害を生じ、下痢や皮膚の異常などの副作用が比較的多く認められます。第三世代EGFR-TKIは、T790M変異のあるEGFRだけでなく元々の変異型EGFRにも効果を発揮しますが、野生型EGFRにはほぼ作用しません。そのため、第一世代、第二世代のEGFR-TKIと比較して副作用が少ないという特徴があります。しかし、残念ながら第三世代EGFR-TKIもやはり1年程度で効果が見られなくなることが知られています。第三世代EGFR-TKIに耐性化する仕組みについては十分明らかになっておらず、この仕組みを解明し、打開することで更に患者さんの寿命を延ばすことができる可能性があります(図1)。
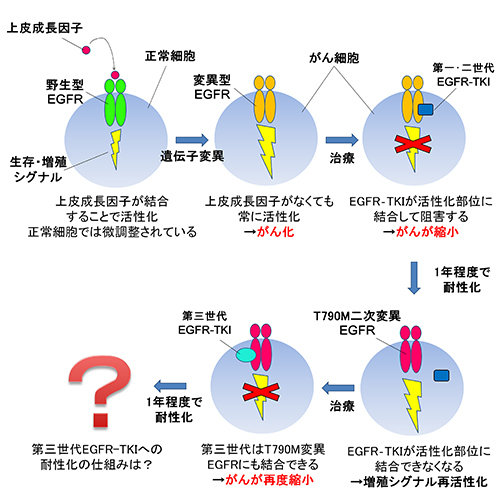
図1.肺がん細胞におけるEGFRとEGFR-TKIの働き
第三世代EGFR-TKIへ耐性化する仕組みの解明
そこで、私たちは耐性化の仕組みを解明するために患者さん由来の肺がん細胞を培養し、第三世代EGFR-TKIを長期間投与し続けることで人工的に耐性細胞を作成しました。得られた細胞が第三世代EGFR-TKIに耐性化しているかどうかを確認した後に、耐性細胞から遺伝子の情報を含む物質であるDNAを採取しました。耐性化の原因となる遺伝子の変化があるかどうかを確認するために次世代シーケンサーと呼ばれる、遺伝子情報を高速かつ大量に解読することができる装置を用いて、採取したDNAの解析を行いました(図2)。
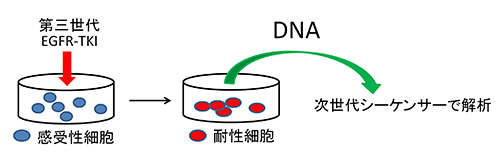
図2.耐性細胞の作成、次世代シーケンサーでの解析
その結果、おもしろいことに耐性細胞では元々あった変異型EGFR遺伝子が少なくなり、正常な野生型EGFR遺伝子の割合が倍増していることが分かりました。実際に作られているEGFRタンパクについても調べてみるとやはり野生型の割合が倍増していました。さらに野生型EGFRを活性化する上皮成長因子の量も測定するとこちらも耐性化前と比べて倍増していることがわかりました。第三世代EGFR-TKIは副作用を減らすために野生型EGFRには作用しないように設計されていますが、がん細胞はこれを逆手にとり、野生型EGFRを増やして活性化させることで耐性化したのではないかと考えました。
私たちはこの現象が本当に耐性化に関係しているのかどうかを確認するために、別の肺がん細胞を使って検証しました。この細胞にわざと野生型EGFRを過剰に発現させ、上皮成長因子も増やした状態で第三世代EGFR-TKIを投与してみたところ、やはり耐性化することがわかりました。そして耐性細胞にセツキシマブという上皮成長因子とEGFRの結合を阻害する薬を第三世代EGFR-TKIと併用して投与したところ、増殖が抑制されることがわかりました。以上より、私たちが作成した耐性細胞は野生型EGFRと上皮成長因子を増幅させることで耐性化していたことがわかりました(図3)。
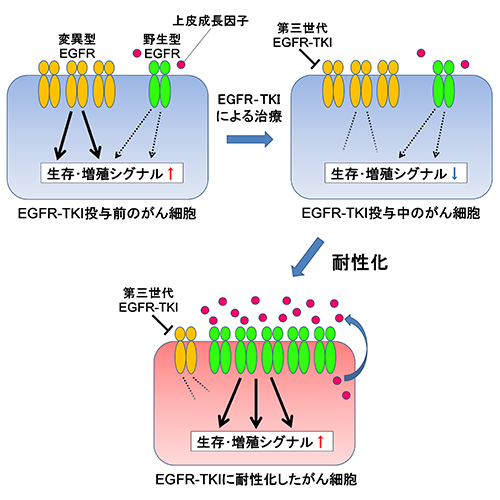
図3.野生型EGFR増幅による第三世代EGFR‐TKIへの耐性化
Amplification of EGFR wild type alleles in non-small cell lung cancer cells confers acquired resistance to mutation-selective EGFR tyrosine kinase inhibitors.
Nukaga S, Yasuda H, Tsuchihara K, Hamamoto J, Masuzawa K, Kawada I, Naoki K, Matsumoto S, Mimaki S, Ikemura S, Goto K, Betsuyaku T, Soejima K. Cancer Res. 2017 Apr 15;77(8):2078-2089.のp.2086 Figure 6Dより改変
今後について
今回私たちは第三世代EGFR-TKIに耐性化する仕組みの一部を解明することができましたが、今後はこの現象が実際の患者さんで見られるかどうかを検証する必要があります。また、患者さんによって耐性化する仕組みは異なることが予想されるため、今回私たちが見つけた仕組みがどの程度の頻度で見られるかについても調べる必要があります。実際の患者さんでも同様の現象が認められれば、セツキシマブ(アービタックス®)は既に大腸がんなどで使用されている薬ですので、この薬を併用することで患者さんの寿命をさらに延長することができるかもしれません。.
本研究は国立研究開発法人国立がん研究センター先端医療開発センタートランスレーショナルリサーチ分野土原一哉先生、三牧幸代先生、同センター東病院後藤功一先生、松本慎吾先生に次世代シーケンサーの解析を含めてご協力いただきました。この場をお借りして深謝致します。
参考文献
Amplification of EGFR wild type alleles in non-small cell lung cancer cells confers acquired resistance to mutation-selective EGFR tyrosine kinase inhibitors.
Nukaga S, Yasuda H, Tsuchihara K, Hamamoto J, Masuzawa K, Kawada I, Naoki K, Matsumoto S, Mimaki S, Ikemura S, Goto K, Betsuyaku T, Soejima K.
Cancer Res. 2017 Apr 15;77(8):2078-2089.doi:10.1158/0008-5472.CAN-16-2359.

前列左から:副島研造(臨床研究推進センター教授)、筆者(現所属:東京医療センター呼吸器科)
後列:安田浩之(内科学教室(呼吸器)専任講師)
最終更新日:2017年8月1日
記事作成日:2017年8月1日