記憶や学習に必須なグルタミン酸の神経伝達
私たちが何かを考えたり体を動かしたりするとき、脳はたくさんの神経細胞が形作るネットワーク上で情報を整理、統合して指令へと変換します。神経どうしはシナプスと呼ばれる場所で、情報のやり取りを行います。このシナプスでの情報のやり取りを神経伝達と呼び、神経伝達物質という分子を使い行っています。一方の神経から放出された神経伝達物質は、向かい合う神経が持つ受容体に結合することで、受け手側の神経を興奮させます。
私たちの脳では神経伝達物質としてグルタミン酸というアミノ酸の一種を利用しています。グルタミン酸はN-メチル-D-アスパラギン酸(NMDA)型受容体に結合して受容体を活性化することで、隣の神経に情報を伝えます。この情報のやり取りが盛んに行われると、シナプスの繋がりが強固になり、記憶や学習をつくると考えられています。
一方で、受容体への刺激が弱かったり強すぎたりすると問題が生じます。刺激が弱く足りない場合、シナプスは十分な情報を受けることができず、シナプス自体を維持することが難しくなります。これが統合失調症(かつては精神分裂病と呼ばれた病気)の原因の一つになっている可能性が報告されています。統合失調症とは、幻聴や幻覚に悩まされ、抑うつ状態になって社会生活が送れなくなる精神疾患で、およそ100人に一人が罹患します。
また、NMDA受容体への刺激が強すぎる場合は神経細胞が刺激に耐えられなくなり、細胞自体が死を選ぶことが知られています。これはグルタミン酸の興奮毒性と呼ばれています。物を覚えられなくなってしまうアルツハイマー病や、身体が動かなくなってしまう筋萎縮性側索硬化症(通称ALS)という病気はNMDA受容体への刺激が強すぎることが原因の一つという仮説があります。このように、NMDA受容体の刺激は正確にコントロールされなければ、私たちの神経伝達は上手くいかず身体は正しく動かすことができません。それではNMDA受容体はどのように制御されているのでしょうか?(図1)
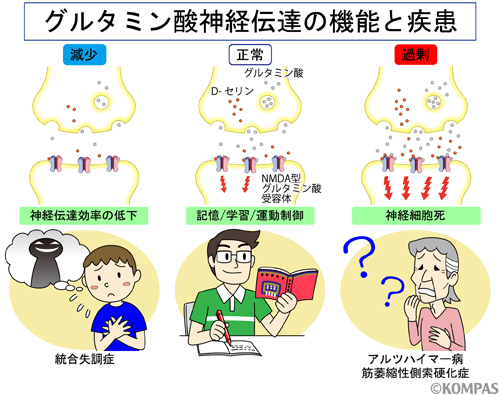
図1.NMDA型受容体を介するグルタミン酸神経伝達の生理作用と病態生理的意義
グルタミン酸神経伝達は記憶や学習に必須の神経伝達です。下流の神経に正常な神経刺激が与えられるとシナプスが強固になり、記憶が保持されると考えられています(中央)。一方、グルタミン酸による神経伝達がうまくいかないと、下流の神経にシグナルを効率的に送ることができず、正常な機能が発揮できません。統合失調症などは一部このような原因で発症すると考えられています(左)。他方、グルタミン酸の神経刺激が過剰におこると神経細胞が興奮しすぎることで刺激に耐えられなくなり、自ら死ぬことを選ぶことが知られています。これはグルタミン酸の神経興奮毒性と呼ばれ、アルツハイマー病や筋萎縮性側索硬化症といった神経変性疾患の原因になっていると考えられています(右)。
NMDA受容体の活性を調節するD-セリン
NMDA受容体は、グルタミン酸の結合だけでは活性化せず、D-セリンという特殊なアミノ酸がグルタミン酸と同時に結合して、はじめて活性化します。グルタミン酸は電源をオン/オフし、D-セリンは刺激のボリュームを調節する役割を担います。したがって、神経の活性を微調整するにはD-セリンの量を調節することが必要になります。しかし、これまでの研究では、D-セリンが脳内でどのように調節されているかは明確にされていませんでした。
D-セリンの新たな調節メカニズムの発見 -エネルギー代謝との関わり-
D-セリンは主に神経で作られていると考えられていますが、私たちはヒトの脳組織において、脳の海馬という特定の領域に存在するグリア細胞がD-セリンを合成する酵素セリンラセマーゼ(SRR)を持つことを見出しました。グリア細胞とは、脳の神経細胞以外の部分を埋めて、神経細胞の機能を様々な面からサポートしている細胞です。主に神経細胞へのエネルギー源の供給や、神経伝達の調節、周囲の代謝物やイオンの調節などを行っています。このグリア細胞がSRRを発現しているということは何を意味するのでしょうか?
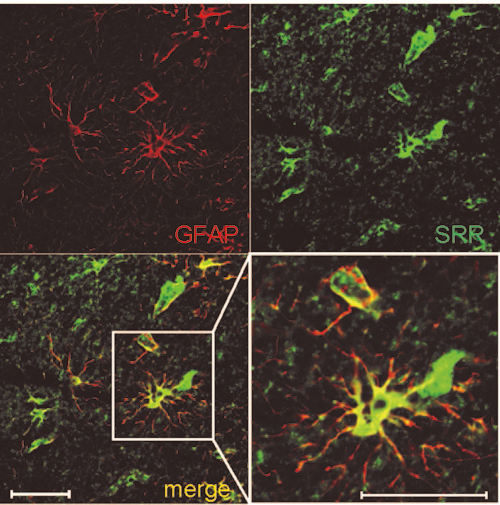
図2.ヒト海馬支脚に存在するD-セリン合成酵素
セリンラセマーゼ(SRR)を緑、グリア細胞(GFAP)を赤で染めています。右下は拡大図です。緑色と赤色が重なったところは黄色く見えます。ヒトの海馬支脚と呼ばれる領域にいるグリア細胞とSRRが重なって黄色に見えることから、グリア細胞にSRRが発現していることが分かります。
グリア細胞は脳の神経細胞にエネルギー源を与えるという作用をし、エネルギー環境を整備しています。血液によって運ばれた糖分は、まずグリア細胞に取り込まれ、解糖系と呼ばれる行程で分解されます。得られた代謝産物(糖分の分解産物)は神経細胞に供給され、神経のエネルギー合成に役立てられます。神経がたくさん活動すると大量のエネルギーを消費します。そのため、グリア細胞は神経の要求に応じて解糖系を回し、代謝産物を神経に与えます。このようにグリア細胞の機能はエネルギー代謝と密接な関係にあることから、D-セリンの合成はエネルギー代謝によって影響を受けるのではないかと予想し、次のような研究を行いました。
まず、グリア細胞にエネルギー合成経路の解糖系を促す刺激を与え、D-セリンの合成量を調べました。するとD-セリンの合成が減っていました。逆に、解糖系を止めるとD-セリンが増えていました。このことから解糖系が活発に働くとD-セリン合成が抑制されると考えられました。続いてD-セリン合成酵素SRRの活性が変化するメカニズムを調べたところ、SRRは解糖系が活性化している時にGAPDHという解糖系の酵素と結合することが分かりました。GAPDHは解糖系の反応の一つを担う酵素です。GAPDHは糖を代謝する時、同時にNADHという分子を作ります。このNADHの増加がSRRの活性を抑えてD-セリンの合成を抑えていました。
このように私たちは解糖系の酵素がD-セリンの合成酵素と結合して、代謝産物を利用しD-セリンの合成を抑えるという全く新しい調節方法を明らかにしました(図3)。
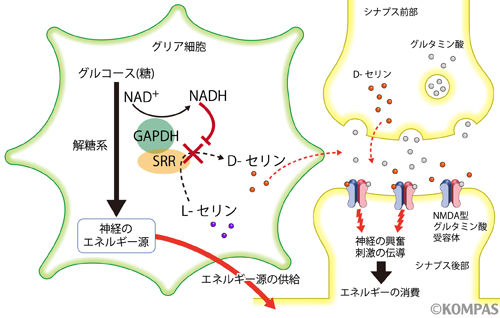
図3.D-セリンの新たな制御機構とグルタミン酸神経伝達の調節
グリア細胞(左)はグルコース(ブドウ糖)から解糖系によって神経のエネルギー源となる分子を作り、神経に供給しています。D-セリンは神経を刺激して電気信号を下流の神経に伝達します。神経が活性化すると多くのエネルギーを消費するので、それに対応してグリア細胞の解糖系が活性化します。解糖系が活性化すると解糖系酵素GAPDHがD-セリン合成酵素SRRに結合し、GAPDHが産生するNADHを利用してD-セリンの合成を阻害します。これによって神経の刺激を抑え、エネルギーが枯渇しないように調節していると考えられます。
エネルギー代謝と神経伝達
それではグリア細胞のエネルギー代謝によってD-セリンが調節されていることは、生理学的にはどんなメリットがあるのでしょうか?
神経活動にはたくさんのエネルギーを必要とします。私たちがたくさん勉強すると疲れを感じ、甘いものが欲しくなるのはこのためです。勉強しているとき、すなわち神経が盛んに活動しているとき、グリア細胞は解糖系を動かして、せっせと神経にエネルギー源を与えます。しかし神経が働き続けエネルギーの要求が多くなってくると、エネルギー源の調達が間に合わなくなってしまい、神経の活動だけでなく、細胞の生存維持やメンテナンスに使うエネルギーまで足りなくなってしまいます。それでは脳の活動を維持することはできません。そこで解糖系の働きを介してD-セリンの合成を抑え、神経の活動自体を抑えることで全体のエネルギーバランスを保っているのではないかと考えられます。
このような制御メカニズムがどのような疾患に関わっているのか、現時点では明らかでありませんが、D-セリンとNMDA受容体の調節不全によって生じる統合失調症などの精神疾患に関係しているかもしれません。今後は疾患との関係も視野に入れてこの分野の研究を進めていきたいと考えております。
参考文献
Glycolytic flux controls D-serine synthesis through glyceraldehyde-3-phosphate dehydrogenase in astrocytes.
Suzuki M, Sasabe J, Miyoshi Y, Kuwasako K, Muto Y, Hamase K, Matsuoka M, Imanishi N, Aiso S.
Proc Natl Acad Sci U S A. 2015 Apr 28;112(17):E2217-24. doi: 10.1073/pnas.1416117112. Epub 2015 Apr 13.
http://www.pnas.org/content/112/17/E2217.abstract![]()
PMCID:PMC4418896 [Available on 2015-10-28]

鈴木 将貴(解剖学教室特任助教)
最終更新日:2015年8月1日
記事作成日:2015年8月1日