筋萎縮性側索硬化症とは
私たちが身体を動かすとき、その指令は大脳皮質から脊髄という場所を下降する上位運動神経と脊髄から動かしたい筋肉まで伝達する下位運動神経を介し伝えられます。筋萎縮性側索硬化症(Amyotrophic lateral sclerosis: ALS)は、この伝達路である二つの運動神経が病気になり減ってしまうことで、脳からの運動指令がうまく身体に伝えられなくなる難病です。米国で国民的に人気のあったメジャーリーグ野球選手ルー・ゲーリックがこの病気で亡くなったことから、ALSはルー・ゲーリック病と呼ばれることもあります。この病気を発症すると、徐々に身体が動かせなくなり、食事や会話も困難になり、発症から2~3年で呼吸が出来なくなってしまいます。人工呼吸器をつければその後何年も生きることができますが、全身の完全な麻痺への進行は不可逆的であり、進行を数か月遅らせる薬はあるものの根治療法はありません。変性するのは運動神経のみであり知覚や意識を保つ神経は機能を保っているため、患者さんは意識がはっきりしたまま徐々に体が動かせなくなります。発症すると急速かつ確実に機能が失われてゆくため、ご家族にかかる介護のための肉体的、精神的、経済的負担がとても大きいのも特徴です。
ALSはアルツハイマー病、パーキンソン病に次いで多い神経変性疾患であり、全世界で毎年14万人が新たにALSと診断され、日本では約9000人の患者さんがいます。発症は40代から70代の方が多く、その10%が家族性で90%は孤発性といわれています。家族性ALSの家系では家族の他のメンバーが若年性認知症の一つである前頭側頭型認知症(Frontotemporal dementia: FTD)を発症する場合があり、同定されている原因遺伝子も重複することから、この二つの病気は近縁疾患であると考えられています。
研究の背景と目的:ALS/FTDとC9orf72遺伝子変異
神経変性疾患の研究では、患者さんが複数いる家系で異常(変異)のある遺伝子を同定し、その遺伝子変異がどのような毒性を引き起こすか解析します。近年ALS/FTDの原因遺伝子が複数見つかってきました(図1)。
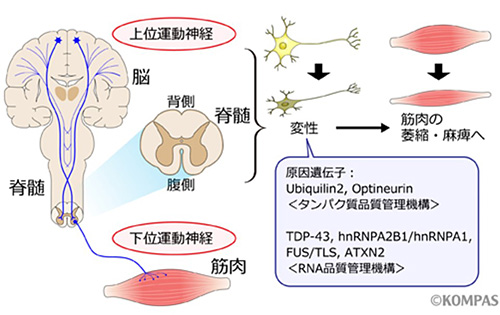
図1.ALSの病態および原因遺伝子
ALSでは脳から脊髄までの上位運動神経と、脊髄から筋肉までの下位運動神経が変性し、麻痺を来します。原因遺伝子としてタンパク質品質管理に関わるものとRNA品質管理に関わるものが報告されています。
2011年、C9orf72という遺伝子の一部でGGGGCCという6塩基の繰り返し配列が700~数千回に拡張してしまうという変異がALS/FTDの原因遺伝子として最も頻度が高いことが報告されました(c9ALS/FTD) [文献1]。この遺伝子自体の神経細胞における役割は分かっていませんが、その病態仮説として、(1)繰り返し配列によりC9orf72遺伝子産物の量が減ってしまうこと(ハプロ不全)、(2)異常なRNAが転写され有毒な高次構造を作り、RNA結合タンパク質を多量に引き寄せてしまうことによるRNA毒性、(3)リピート配列に関連してATG開始コドン無しで翻訳が開始されてしまい(RAN翻訳)、生成する2アミノ酸繰り返しペプチド(dipeptide repeat protein: 以下DRP)による蛋白毒性の3つが提唱されています。RAN翻訳によって生成されるDRPには、ポリグリシン-アラニン(poly-GA)、グリシン-プロリン(poly-GP)、グリシン-アルギニン(poly-GR)、プロリン-アラニン(poly-PA)、プロリン-アルギニン(poly-PR)の5種類があります。ALS/FTDの患者さんの神経組織にはTDP-43というRNA結合タンパク質が異常に蓄積し、特徴的な凝集塊(封入体という)として観察されますが、C9orf72遺伝子変異を持つ患者さんの組織ではこの他に、ユビキチン・プロテアソーム系(UPS)というタンパク質分解装置行きの伝票であるユビキチンおよび、もう一つの分解装置であるオートファジー行きの伝票であるp62が陽性の封入体として、これらのDRPが溜まっていることが近年明らかになりました(図2)[文献2]。
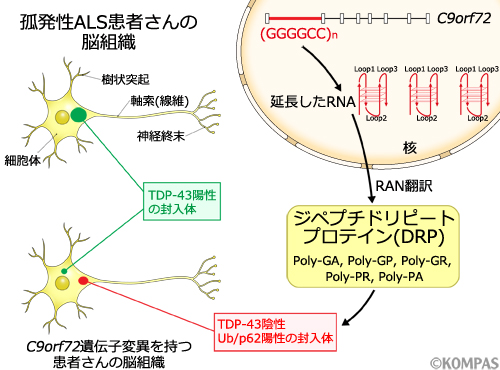
図2.C9orf72遺伝子変異と蛋白凝集
C9orf72遺伝子変異を持つ患者さんの脳には、ALS患者さんの脳に一般的にみられるTDP-43の凝集塊の他に、ユビキチン・p62陽性の凝集塊としてDRPが蓄積します。
本研究はこれらのDRPが神経細胞に対してどのような毒性を持つのかを解析することを目的とし、各DRPの生理活性を延長RNA自体の毒性から分離して解析するために、GGGGCCリピートを持たずにそれぞれのDRPをコードするプラスミドを合成し、培養細胞および胎児マウス大脳に遺伝子導入して解析を行いました。
Poly-GAはユビキチン/p62陽性封入体を、poly-GR/PRはTDP-43陽性封入体を形成する
5つのDRPをコードするプラスミドを培養細胞に導入し観察したところ、poly-GA、poly-GRおよびpoly-PRは細胞内に凝集塊を形成することが分かりました(図3)。子宮内電気穿孔法という方法を用いて胎児マウスの大脳に遺伝子導入を行った場合も同様に観察されました(図3)。poly-GAの凝集塊は、患者さんの脳で見られるものと同じで上述のユビキチンやp62陽性でした。一方poly-GRおよびpoly-PRは核に集積し、細胞質にも封入体を形成していました(図4)。これらの封入体はpoly-GAと異なり、TDP-43をはじめとした様々なALS関連RNA結合タンパクをリクルートしていることが分かりました。これらの結果から、poly-GAは細胞内で難溶性の凝集塊をつくり、これはc9ALS/FTDに特徴的な凝集塊と類似していたのに対し、 poly-GRやpoly-PRなどの塩基性DRPはこれまでに報告されているALS/FTD関連RNA結合タンパクの局在を変化させうることが明らかになりました。
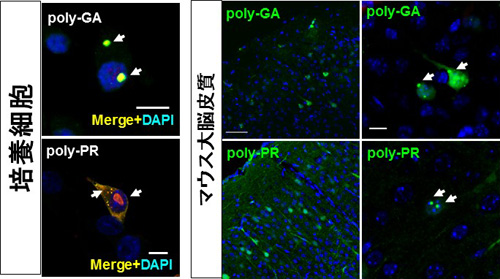
図3.poly-GAの凝集塊
poly-GAは培養神経細胞およびマウス大脳皮質にて凝集塊を形成し、これはc9ALS/FTDに特徴的な凝集塊と類似していました。
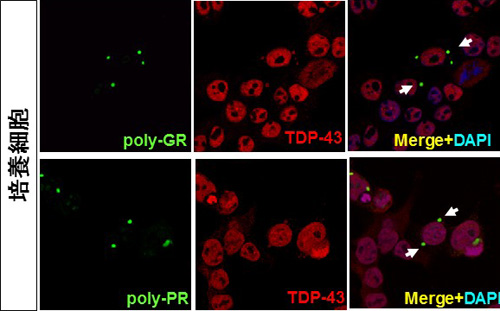
図4.poly-GR,PRの凝集塊とTDP-43
poly-GRおよびPRは、poly-GAと異なりTDP-43陽性の凝集塊を形成していました。
DRPはユビキチン・プロテアソーム系の障害を引き起こし、神経毒性を発揮する
DRPを入れた神経細胞を詳細に解析するとpoly-GA, poly-GP, poly-GRはUPSを障害して、細胞内のタンパク質分解を滞らせることが分かりました。さらに細胞毒性を定量したところ、これらのDRPはプロテアソーム阻害剤に対する細胞の感受性を上げ、細胞毒性を引き起こすことがわかりました。Poly-GRはプロテアソーム阻害剤なしでも有意に細胞毒性を発揮し、UPS障害以外にも毒性を及ぼす機序があることが考えられました。
C9orf72遺伝子における6塩基リピート拡張はALS/FTDの最も頻度の高い遺伝子変異であり、これまで異常に長いRNAによる毒性が主たる病因であると考えられていました。しかし本研究により、RAN翻訳産物であるDRPはユビキチン・プロテアソーム系を障害し、細胞毒性をもつことが明らかになり、これらのタンパク質はALS/FTDの新規治療ターゲットになりうることが示唆されました。
研究のまとめと今後の展望
神経変性疾患研究では、異常タンパクを核とした凝集塊がプリオン病のように神経系の中で広がっていくというBraak仮説が近年提唱され、アルツハイマー病におけるタウやパーキンソン病におけるα-シヌクレインの異常凝集塊を神経細胞に導入すると正常タンパクを巻き込んで凝集塊を増やし、神経系内を広がっていくことが報告されています(図5)[文献3, 4]。
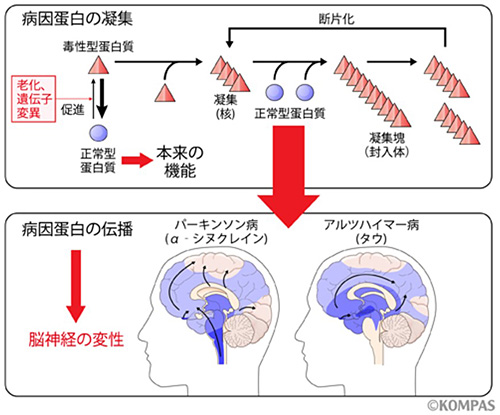
図5.神経変性疾患の病因蛋白の凝集と伝播
老化や遺伝子変異によって生じた毒性型蛋白質が少数凝集して核を作り、それが正常型蛋白質を巻き込んで巨大化して、この一部が分裂して新たな核になって伝播していくと神経変性を引き起こすと考えられており、蛋白凝集は疾患によって特有の伝播経路を示します。
生まれたときから発現しているはずのRNAが、大人になって突然毒性を発揮し変性疾患を発症するよりも、長い間健康であった人の神経系で、ある日、種となる異常タンパク質凝集が発生し、クロイツフェルト・ ヤコブ病のように脳の中で広がっていく、という仮説の方が、疾患の自然経過に適っていると私たちの研究グループでは考えています。C9orf72遺伝子変異によるDRPはタンパク質品質管理機構を障害し、RNA結合タンパク質と干渉してこのようなタンパク凝集を発生しやすくする可能性が示唆されました。(図6)
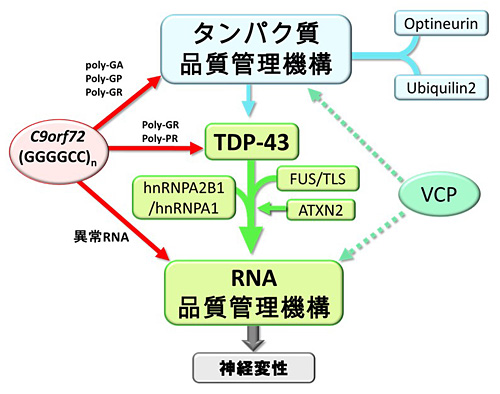
図6.まとめ
本研究により、C9orf72遺伝子変異より生じるDRPはタンパク質品質管理機構を障害し、TDP-43の凝集を引き起こして神経を変性させるという病態機序が示唆されました。
これまで原因不明の難病と言われていたALSは、近年遺伝子研究の発展によりその病気のメカニズムが少しずつ紐解かれつつあります。ALSの中で頻度の高いC9orf72遺伝子変異の病気の機序を明らかにすることで、c9ALS/FTDの病態機序だけでなく、ALSそのものの根治療法開発に近づくことが出来ると期待されます。今後も神経難病の病態解明と治療法開発のために、患者さんとご家族と寄り添うケアを行いながら研究に邁進していく所存です。
参考文献
Characterization of the dipeptide repeat protein in the molecular pathogenesis of c9FTD/ALS.
Yamakawa M, Ito D, Honda T, Kubo KI, Noda M, Nakajima K, Suzuki N.
Hum Mol Genet. 2014 Nov 14. pii: ddu576. [Epub ahead of print]
http://hmg.oxfordjournals.org/content/24/6/1630.long![]()
【本研究に先行する参考文献】
- DeJesus-Hernandez M, Mackenzie IR, Boeve BF, Boxer AL, Baker M, Rutherford NJ, Nicholson AM, Finch NA, Flynn H, Adamson J. et al. Expanded GGGGCC hexanucleotide repeat in noncoding region of C9ORF72 causes chromosome 9p-linked FTD and ALS. Neuron. 2011 Oct 20;72(2):245-56.
- Mori K, Weng SM, Arzberger T, May S, Rentzsch K, Kremmer E, Schmid B, Kretzschmar HA, Cruts M, Van Broeckhoven C. et al. The C9orf72 GGGGCC repeat is translated into aggregating dipeptide-repeat proteins in FTLD/ALS. Science. 2013 Mar 15;339(6125):1335-8.
- Jucker M, Walker LC. Pathogenic protein seeding in Alzheimer disease and other neurodegenerative disorders. Ann Neurol. 2011 Oct;70(4):532-40.
- Brundin P, Melki R, Kopito R. Prion-like transmission of protein aggregates in neurodegenerative diseases. Nat Rev Mol Cell Biol. 2010 Apr;11(4):301-7.

最終更新日:2015年3月1日
記事作成日:2015年3月1日