肥大型心筋症とは
肥大型心筋症(Hypertrophic cardiomyopathy; 以下HCM)は心臓の筋肉が異常に太った状態(肥大)となり、その結果全身へ十分な血液が送り出せなくなり心不全や不整脈、突然死などを呈する疾患です(図1)。そのような症状はないものの心臓の形態的な変化のみをもつ例も含めると、HCMの発生頻度は人口10万人あたり400~500人と決して珍しい疾患ではありません。
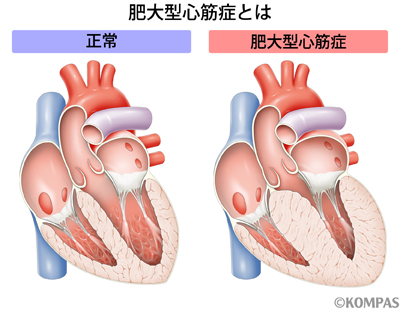
図1 肥大型心筋症
一般にHCMの原因は心筋細胞を構成する収縮関連タンパクの遺伝子変異による常染色体優性遺伝の疾患と考えられています。収縮関連タンパクにおける遺伝子変異が起こる場所やその種類には非常に多くのバリエーションがある一方で、遺伝子検査によっても明らかな変異が確認されない例もあります。さらに、症状が出てくる時期も小児期から壮年期まで広く分布しており、HCMの患者さんの遺伝的背景や病歴はさまざまである点も特徴です。疾患の根本的な原因が遺伝子変異であるため、未だその変異を直接治療することは出来ず、症状に対する対症療法が実際の治療の中心となっています。そのため、症状を抑えることはできても疾患自体の進行を食い止めることは難しいのが現状です。
研究の背景と目的 ~HCMの病態解明を目指して~
HCMにおいて、遺伝子変異がどのようなプロセスを経て実際の心臓症状の発現につながっているのかはまだ明らかになっていません。そのメカニズムを解明することは、より効果的な治療法の開発にとても重要と考えられています。今回の研究を行うに当たり、生まれ持った病的な遺伝的背景に加えて、何らかの後天的な二次的要因がその遺伝的背景を修飾することによりHCMの病態が進行すると私たちは仮定しました(図2)。この考えは以前から提唱されており、原因となる特定の遺伝子を改変した動物疾患モデル(マウスやウサギなど)を用いた実験が行われてきました。しかし、前述の通りHCMの遺伝的背景は非常に多岐に渡っていて、ヒトとその他の動物との間には遺伝的な差異がそもそも存在するためその検証には限界がありました。この問題を解決するためには、HCMの遺伝的特徴をもつ「ヒトでの疾患モデル」の構築が重要であると考えました。
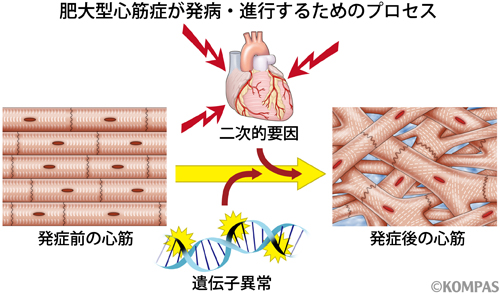
図2 肥大型心筋症の発病・進行プロセス
そこで、私たちが注目したのは2006年に京都大学の山中教授らによって開発・報告された人工多能性幹細胞(induced pluripotent stem cell; 以下iPS細胞)です。iPS細胞はヒトの細胞(皮膚細胞や血液など)に特定の遺伝子を導入し一定の状況で培養することにより作製することができる万能細胞です。iPS細胞はその起源となった個人の遺伝情報がそのまま引き継がれるため、ある疾患をもつ患者さんの細胞から作製されたiPS細胞はその疾患の遺伝的情報も引き継ぐとされています。iPS細胞の開発から間もなくして、従来の研究手法では解明困難であった難治性疾患患者からのiPS細胞(疾患特異的iPS細胞)を用いた研究が世界中で行われてきました。さらに、心臓領域においても遺伝性心疾患患者由来のiPS細胞を用いた研究が相次いで報告されました。そこで私たちはHCMの患者さんから疾患特異的iPS細胞を作製し、続いて心筋細胞を分化誘導することにより、この一連のシステムをHCMの遺伝情報をもつ「ヒトHCMモデル」として研究に用いることとしました(図3)。
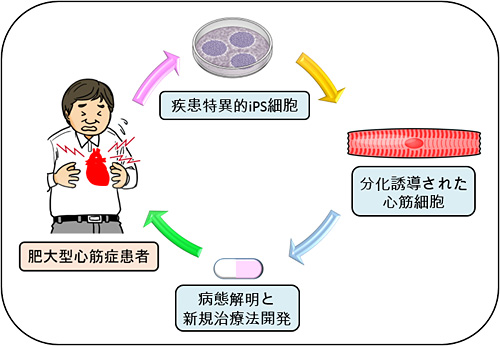
図3 研究のながれ
HCM患者由来のiPS細胞は病的特徴をもっている
今回の研究では3名のHCM患者さんと比較対象として健常者3名からそれぞれiPS細胞を作製し、心筋細胞への分化誘導を行いました。HCMの心筋細胞がもつ最大の特徴はその名前が示す通り、細胞が肥大している点にあります。得られた心筋細胞径を計測してみると、患者さんの個体を一度離れiPS細胞を経由して得られた心筋細胞であるにも関わらずやはりHCM群では有意に肥大していることが判明しました。さらに、HCMの形態的なもう一つの特徴として、心筋細胞の配列がランダムになること(錯綜配列)が知られています。そこで、私たちは個々の心筋細胞内の線維の配列に着目しました(図4上)。すると、HCM群では心筋細胞内の線維の配列が健常者群と比べて高率に乱れていることが判明しました。以上より、細胞肥大と心筋細胞内の線維の乱れといったHCMに特徴的な所見(表現型)が、患者さん由来のiPS細胞から人工的に得られた心筋細胞においても再現されていることが明らかになりました。
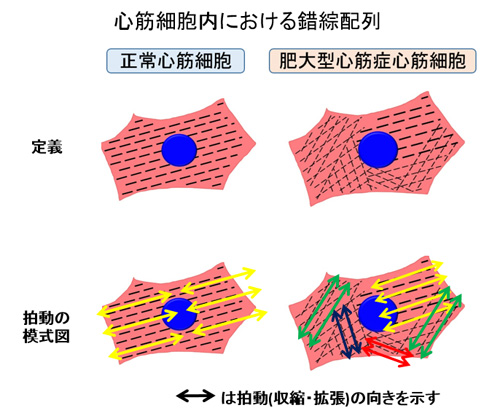
図4 心筋細胞内における錯綜配列
エンドセリン-1はHCMの病態悪化に関与する
次に、この表現型をさらに促進する後天的な因子の候補としていくつかの細胞肥大因子による刺激を心筋細胞に加えました。その結果、エンドセリン-1といわれるホルモンが表現型を最も強く誘発していました。そこで、このエンドセリン-1が心筋細胞に作用する際に働く受容体(エンドセリンA型受容体)を拮抗薬により阻害したところ、病的所見の発生を抑制できることが判明しました。これらの結果から、HCMにおいてもともと心筋細胞の構造的異常がわずかに存在しており、エンドセリン-1により徐々に病態が悪化していくことが想定されました(図5)。
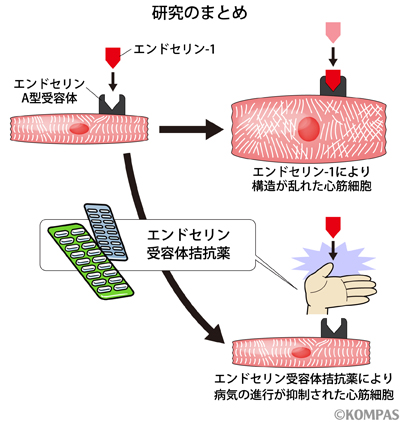
図5 研究のまとめ
心筋細胞内の構造は拍動に影響を及ぼしている
病的所見の指標の一つとして用いた細胞内線維の配列については、従来あまり詳しい研究は行われていませんでした。そこで、本研究では異常な配列をもつ心筋細胞が心筋細胞の基本である拍動(収縮・拡張)に及ぼす影響について解析をしました。拍動するiPS細胞由来の心筋細胞を高速カメラで撮影し、独自に開発した解析ソフトで心筋線維の動きを解析しました。その結果、正常な配列をもつ個々の心筋細胞は全体が協調して拍動したのに対して、配列が乱れた心筋細胞では拍動の協調性が失われ、細胞内の各部位がバラバラな方向に拍動していることが判明しました(図4下)。今回の研究はあくまで個々の細胞での現象ですが、そのような細胞が多く集まり組織や臓器を形成した際には効率的な拍動が出来なくなり、ひいては心機能障害につながる可能性も考えられ、更なる研究が期待されています。
研究のまとめと今後の展望
HCMの患者さんから作製したiPS細胞を用いることにより、患者さんのもつ遺伝的な背景をベースにして、後天的な因子としてエンドセリン-1がHCMの病態悪化に強く関与しており、エンドセリン受容体拮抗薬による治療効果があることが判明しました。今回の研究結果は、後天的な因子(エンドセリン-1)を制御することによりHCMの発症予防や重症化を抑制することができる可能性を示唆するものです。特に、エンドセリン受容体拮抗薬はすでに肺高血圧症の一般的な治療薬として広く使用されていることから、新規の治療薬をゼロから開発するのに比べるとHCM患者での治療効果を検討する臨床研究などを行うハードルは低いと思われます。今後、HCMとエンドセリン-1との詳細な関連について研究を進めることによって、治療薬開発に関わる臨床研究に朗報がもたらされると期待されます。
参考文献
- Endothelin-1 induces myofibrillar disarray and contractile vector variability in hypertrophic cardiomyopathy-induced pluripotent stem cell-derived cardiomyocytes.
Tanaka A, Yuasa S, Mearini G, Egashira T, Seki T, Kodaira M, Kusumoto D, Kuroda Y, Okata S, Suzuki T, Inohara T, Arimura T, Makino S, Kimura K, Kimura A, Furukawa T, Carrier L, Node K, Fukuda K.
J Am Heart Assoc. 2014 Nov 11;3(6). pii: e001263. doi: 10.1161/JAHA.114.001263.
http://jaha.ahajournals.org/content/3/6/e001263.long

左:筆者、右:湯浅 慎介(循環器内科 学部内専任講師)
最終更新日:2015年1月1日
記事作成日:2015年1月1日