はじめに
神経幹細胞は神経系の難病に対する再生医療に用いる移植細胞として効果があることがわかっています。神経幹細胞は体の中に移植されると、ニューロン(神経細胞)やグリア細胞といった神経系の細胞に分化して難病の患者さんで症状の改善をもたらすのではないかと期待されており、神経幹細胞をiPS細胞から誘導して、近い将来の再生医療に用いようと考えられています。しかしながら、本学の生理学教室のこれまでの研究では、iPS細胞から神経幹細胞への誘導は、患者さんの細胞からiPS細胞を作るプロセスがまず必要であり、さらに神経幹細胞へ分化誘導するプロセスを合わせると、現在の技術では半年近い期間がかかります(1)。さらにiPS細胞はクローンごとに安全性が大きく異なり、移植のためには安全なクローンを選ぶ時間も必要です(2)。私たちはこれらの問題の解決を試みました。
iPS細胞作製法+ニューロスフェア法=?
2007年にヒトiPS細胞の樹立が報告され、iPS細胞の有効性が大きく期待されるようになりました。翌2008年に、医学部4年生の大野聡一郎君(90回生)は、医学部のカリキュラムの一環として行われる「自主学習」プログラムで生理学教室での研究を始めました。私は長く神経幹細胞を研究しておりますが、その直前のトロント大学留学時代には、ES細胞から神経幹細胞を誘導する研究を行っていました(3)。
線維芽細胞からiPS細胞を作る際に、初期化のための遺伝子導入を行った数日後にiPS細胞の培養条件へと切り替えますが、これを神経幹細胞の培地に変更すれば神経幹細胞が短い期間でそのまま誘導できるのではないかと考えました。そこで問題になったのは誘導の効率です。iPS細胞の誘導効率は当時の方法で約0.1%でした。当時の当生理学教室の技術ではES/iPS細胞からの神経幹細胞の誘導効率は1%であったため、2つの技術を組み合わせた場合に予想される誘導効率は0.001%程度になることが推測されました。そこで、遺伝子導入をした線維芽細胞を通常の10倍の濃度(100,000細胞/ml)で神経幹細胞誘導培地の中で培養することにして、5mlの培地を入れた培養フラスコで500,000個の細胞の培養を開始しました。もしも0.001%しか神経幹細胞ができないとすると、できるニューロスフェア(神経幹細胞の塊)は10個以下と言うことになります。
一週間後、フラスコの中にわずか3個の小さな細胞の塊ができていました。私たちはこの細胞の塊が神経幹細胞からできたニューロスフェアであることを確かめるため、分化誘導を行いました。ニューロスフェアを形成する神経幹細胞は、ニューロン(神経細胞)とグリア細胞(アストロサイト、オリゴデンドロサイト)に分化する性質を持っています。しかしながら、ES/iPS細胞から誘導した神経幹細胞は、最初はニューロンのみを主に生み出して、培養を続けるにつれて成熟した神経幹細胞となりグリア細胞を生み出すことが観察されていました。
私は大野君に「おそらくニューロンしかできてこないと思うけど、一応GFAP(アストロサイトのマーカー)も免疫染色しておこうか。」と、伝えました。数日後、彼は不思議そうな顔をして私のところにやってきました。「免疫染色はうまくいったと思うんですが、GFAP陽性の細胞が沢山いるように見えるんです。」大野君はわずか3個のニューロスフェアを使って、彼にとっては初めて行う分化誘導と免疫染色の実験を成功させていました。しかしながら顕微鏡を覗いてみると、確かにアストロサイトと思しき細胞が多数観察されました。この結果は何度か繰り返しても同じ結果が得られました(図1)。そのため、私たちは線維芽細胞から直接誘導した神経幹細胞は、もしかしたら性質が異なるのではないかと考えました(図2)。
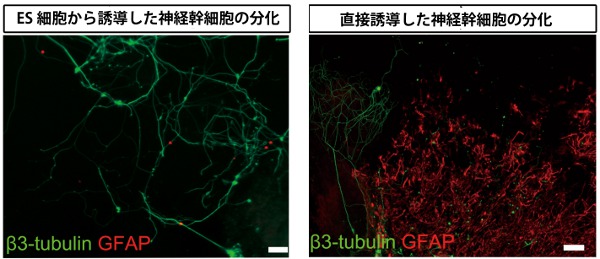
図1 ES細胞から誘導した神経幹細胞(左)と線維芽細胞から直接誘導した神経幹細胞(diNSC)(右)の分化
説明:直接誘導した神経幹細胞からは明らかに多くのGFAP陽性のアストロサイトが分化しているようすがわかる。(文献4から一部改変)
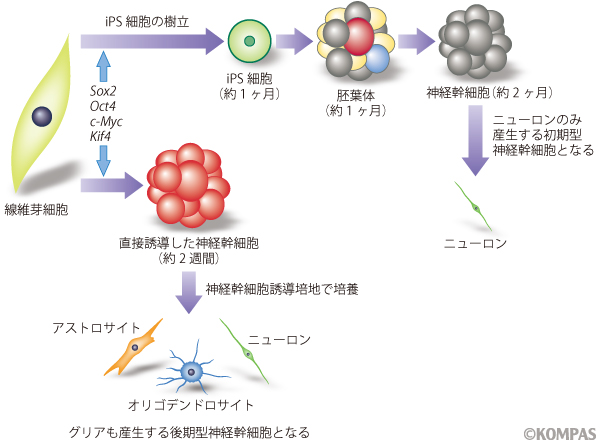
図2 直接誘導した神経幹細胞(diNSC)はiPS細胞を経由して誘導した神経幹細胞と性質が異なる
効率よく安全な直接誘導神経幹細胞を作製する
この直接誘導した神経幹細胞(diNSC)が、ES/iPS細胞由来の神経幹細胞よりも速く分化する性質を持っていることを証明し、diNSCの誘導法を高品質・高効率なものにしたのは大学院生の松井健君(現、スタンフォード大研究員)です。松井君は様々な培養条件で繰り返し検討し、再生医療で問題になる残存する多能性細胞(腫瘍のもとになる)を取り除き、成熟したdiNSCだけを100倍の効率で培養する方法を確立しました。この方法により、直接誘導した細胞は培養条件を工夫するだけで安全な細胞を大量に作製できる可能性が見えてきました。
一方、整形外科大学院生の高野盛登君(84回生)によって、ヒトの線維芽細胞からもdiNSCが誘導されることが示されました。ヒトdiNSCの誘導はきわめて難しく、私たちの論文発表(4)と前後して同様に神経幹細胞を直接誘導したという報告がいくつか発表されましたが、成体のヒト細胞からの誘導に成功したのは本報だけでした。
今後は質・量の両面から再生医療に使えるようなヒトdiNSCをいかに誘導するかを課題としています。現在の技術では不可能とされる再生医療が将来的には可能となるように、安全に迅速に目的の細胞を得るような方法をこれからも開発していきたいと考えています。
参考文献
- Grafted human-induced pluripotent stem-cell-derived neurospheres promote motor functional recovery after spinal cord injury in mice.
Nori S, Okada Y, Yasuda A, Tsuji O, Takahashi Y, Kobayashi Y, Fujiyoshi K, Koike M, Uchiyama Y, Ikeda E, Toyama Y, Yamanaka S, Nakamura M, Okano H.
Proc Natl Acad Sci U S A. 2011 Oct 4;108(40):16825-30. doi: 10.1073/pnas.1108077108. Epub 2011 Sep 26.
http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3189018/
- Variation in the safety of induced pluripotent stem cell lines.
Miura K, Okada Y, Aoi T, Okada A, Takahashi K, Okita K, Nakagawa M, Koyanagi M, Tanabe K, Ohnuki M, Ogawa D, Ikeda E, Okano H, Yamanaka S.
Nat Biotechnol. 2009 Aug;27(8):743-5. doi: 10.1038/nbt.1554. Epub 2009 Jul 9.
http://www.nature.com/nbt/journal/v27/n8/abs/nbt.1554.html?lang=en
- Suppression of Oct4 by germ cell nuclear factor restricts pluripotency and promotes neural stem cell development in the early neural lineage.
Akamatsu W, DeVeale B, Okano H, Cooney AJ, van der Kooy D.
J Neurosci. 2009 Feb 18;29(7):2113-24. doi: 10.1523/JNEUROSCI.4527-08.2009.
http://www.jneurosci.org/content/29/7/2113.long
- Neural stem cells directly differentiated from partially reprogrammed fibroblasts rapidly acquire gliogenic competency.
Matsui T, Takano M, Yoshida K, Ono S, Fujisaki C, Matsuzaki Y, Toyama Y, Nakamura M, Okano H, Akamatsu W.
Stem Cells. 2012 Jun;30(6):1109-19. doi: 10.1002/stem.1091.
http://onlinelibrary.wiley.com/doi/10.1002/stem.1091/full

赤松和土(生理学教室専任講師)
最終更新日:2013年10月1日
記事作成日:2013年10月1日