がん幹細胞とは
これまで、がん組織に存在する全てのがん細胞は、無限に自分と同じ性質を持った細胞のコピーを生み出す能力を持っており、元のがん組織と同様のがんを形成する能力を獲得していると古典的には考えられていました。しかし、近年の様々な研究によって、がん組織においても、正常組織に見られるような幹細胞システムが存在するのではないかと考えられるようになりました。つまり、がん組織は、少数のがん幹細胞と、そこから生み出された非がん幹細胞から成り立っていると考えられるようになってきました。
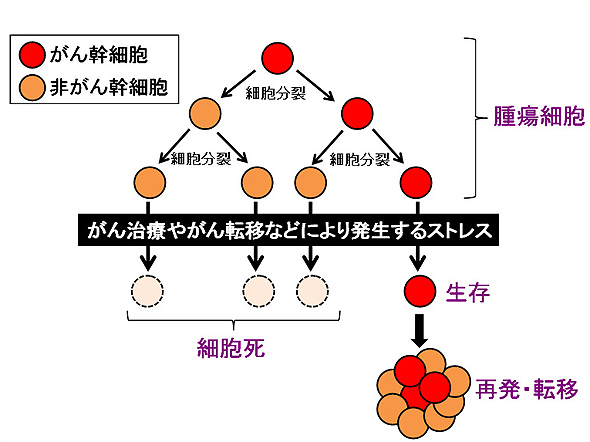
図1.がん幹細胞と再発・転移の関わり
がん幹細胞は、そこから生み出される非がん幹細胞と比較して、様々なストレスに対して抵抗性を有している。そのため、がん治療やがんの転移過程などの際に生じるストレスに対して生き残り、再びがん組織を形成する。
この構図はちょうど、蜂の社会における女王蜂(がん幹細胞)と働き蜂(非がん幹細胞)の関係にあてはめることができます。このがん幹細胞が、臨床的に問題視されるのは、がん幹細胞が非がん幹細胞と比較して、様々なストレスに対し、高い抵抗性を持っていることにあります。そのため、抗がん剤や放射線などのがん治療に対しても抵抗性が高いがん幹細胞は生き残り、治療後の再発や転移に繋がるのではないかと考えられています。そこで今後は、がん幹細胞を標的にした治療を考案する必要があると考えられています。
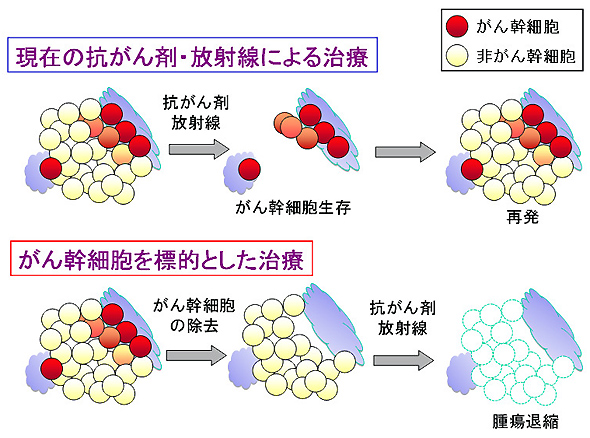
図2.がん幹細胞モデルに基づく癌治療の変化
現在の抗癌剤や放射線治療によるがん治療によって、腫瘍の大部分を占める非がん幹細胞は死滅するものの、治療抵抗性を持つがん幹細胞が生き残ることが有り、その結果、一次的に腫瘍が縮小していても、がんの再発が生じる。そのため、がん幹細胞を標的とした治療法の確立が必要とされる。
がん幹細胞の抗酸化システム
細胞にストレスを与える要因の一つである活性酸素は、大気中に存在する酸素分子が、より反応性の高い化合物に変化することで発生します。一般に、酸素が存在する環境で増殖する細胞は、酸素を利用する方法で必要なエネルギーを産生していますが、この方法は効率的にエネルギーが獲得できる代わりに活性酸素が発生します。一方、がん細胞の多くは、活性酸素の発生を減らすために、酸素を利用しない非効率的なエネルギー産生を行うとともに、この有害な物質である活性酸素を除去する機構(抗酸化システムと呼びます)を発達させています。このように、増殖の盛んながん細胞は生存のために、できるだけ活性酸素が蓄積しないような戦略を取ります。
過剰な量の活性酸素が細胞内に蓄積すると、細胞の構成成分である脂質(膜)、タンパク質やDNAなどに作用し、変性や障害といった深刻なダメージを与えます(酸化ストレス)(注1)。また、がん治療に用いられる放射線や一部の抗がん剤は、がん細胞に過剰な活性酸素を発生させることで酸化ストレスを誘導し、細胞障害作用を発揮します。しかし、がん細胞の持つ抗酸化システムは、がん細胞を殺すために必要な活性酸素も除去するため、これらの治療効果を減弱させてしまいます。さらに最近の研究では、がんのなかでも、がん幹細胞は活性酸素を除去する能力がとくに高く、治療に対して高い抵抗性を持っていることが明らかになってきました。私たちの研究グループは、このがん幹細胞の持つ抗酸化システムに着目して研究を行い、がん幹細胞マーカーであるCD44と呼ばれる分子が関係していることを見い出しました。
注1)酸化ストレス
活性酸素の蓄積などにより、酸化反応と抗酸化反応のバランスが崩れた結果、過剰な酸化反応により有害な作用が生じる状態。
がん幹細胞マーカーCD44の機能的役割
一般に、ある特定の細胞の膜表面にのみ発現する分子を「細胞マーカー」と呼びます。つまり、がん幹細胞にのみ特異的に発現する分子が、がん幹細胞マーカーということになります。そのようなマーカーを手がかりにすれば、がん幹細胞を含む細胞集団をがん組織から取り出し、基礎的な研究から臨床まで、幅広く役立てることができるようになります。私たちのグループは最近、乳がん、胃がん、大腸がん、前立腺がん、頭頸部扁平上皮がんといった固形がんにおける主要ながん幹細胞マーカーとして知られているタンパク質CD44のスプライスバリアント(CD44 バリアント:CD44v)(注2)が、シスチントランスポーター(注3)を細胞表面に安定化し、細胞外に少量存在するシスチンというアミノ酸の取り込みを促進する役割を持つことを見つけました。細胞内に取り込まれたシスチンは、その後システインというアミノ酸に変化し、強力な抗酸化物質であるグルタチオンを合成するための材料になります。
このグルタチオンには、活性酸素を除去して細胞を酸化ストレスから保護する働きが有ります。そのため、がん細胞においてもグルタチオンが大量に存在すると、放射線や抗がん剤によって受ける酸化ストレスやダメージからも、がん細胞は回避しやすくなり、治療抵抗性を獲得するようになります。つまり、がん幹細胞がCD44vを細胞膜に多く発現する一つの大きな理由は、シスチンの取り込みを増やし、抗酸化物質グルタチオンの合成を高めることで、酸化ストレスから身を守っていることが考えられます。
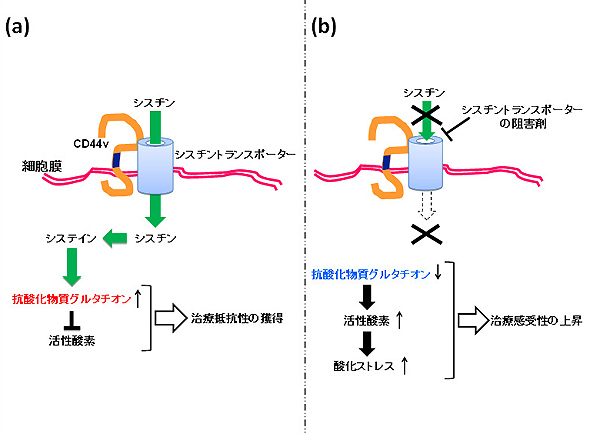
図3.CD44vによるシスチン取り込みの促進とその阻害による治療
(a) がん幹細胞の表面にあるCD44vは、シスチントランスポーターを細胞表面に安定化し、細胞外シスチンの取り込みを促進するため、がん幹細胞は、強力な抗酸化物質グルタチオンを大量に生成することで、治療抵抗性を獲得している。
(b) CD44vを高発現するがん幹細胞に対しては、シスチントランスポーターを特異的に阻害することで酸化ストレスを誘導し、治療抵抗性を失わせることが必要である。このように、がん組織から治療抵抗性を持つがん幹細胞を取り除くような治療を組み合わせることで、従来のがん治療の効果を高めることができる。
注2)CD44のバリアントアイソフォーム
CD44には、メッセンジャーRNA (mRNA) の選択的スプライシング(注2-a)により多種類の産物ができることが知られている。CD44vはそのうち、がん組織で高発現するアイソフォーム(若干異なる構造を持つタンパク質)。
注2-a)選択的スプライシング
DNAから転写されたmRNAが成熟する過程で、同一遺伝子から異なる組み合わせでエクソン(塩基配列中で成熟mRNAに残る部分)を結合したmRNA分子が生成され、遺伝子産物に多様性が増す機構。
注3)シスチントランスポーター
細胞の表面には、外から必要なものを取り込んだり不要なものを排出したりするための多くの輸送体タンパク質(トランスポーター)が存在する。シスチントランスポーターとは、そのうち細胞外に存在するシスチンを細胞内に取り込むための輸送体のこと。
CD44vによる酸化ストレス抵抗性を標的とした治療戦略
私たちは、このような理論に基づき、現在CD44vがシスチンの取り込みやグルタチオン合成を促進している分子機構を狙い撃ちするような治療、つまりがん幹細胞の一つの特性である酸化ストレス抵抗性を標的とした治療の開発を行っています。慢性関節リウマチや潰瘍性大腸炎の治療薬として長く用いられてきたスルファサラジンという薬剤は、CD44vによって促進されているシスチンの取り込みを特異的に阻害する効果があり、がん細胞内のシステイン欠乏を引き起こし、グルタチオン合成を効果的に抑えることができることが分かりました。がん細胞を移植したマウスを治療した実験では、スルファサラジンの投与は、がん組織からCD44v陽性のがん細胞のみを死滅させて取り除き、抗がん剤に対する感受性を高めることが出来ることを見出だしました。 このように、CD44vを発現するがん幹細胞に対して、シスチンの取り込みをブロックして酸化ストレスを誘導することが出来れば、現在のがん治療に対して抵抗性を示すがんに対しても効果的な治療が出来るようになると考えています(図3b参照)。
おわりに
がん組織が、がん幹細胞と非がん幹細胞といった、全く異なる性格や薬剤感受性を持った細胞が集合した不均一な組織である限り、単一の治療法で全てのがん細胞を死滅させることは困難かも知れません。しかしながら、がん幹細胞と非がん幹細胞のそれぞれにおいて活性化されている細胞内シグナルや代謝の違いを解明し、それらを標的とした薬剤を適切に併用することで、治療抵抗性を持つがんにおいても、治療効果を上げることが今後は期待されます。
参考文献
Redox regulation in stem-like cancer cells by CD44 variant isoforms.
Nagano O, Okazaki S, Saya H.
Oncogene. 2013 Jan 21. doi: 10.1038/onc.2012.638. [Epub ahead of print]
http://www.nature.com/onc/journal/vaop/ncurrent/abs/onc2012638a.html![]()
xCT Inhibition Depletes CD44v-Expressing Tumor Cells That Are Resistant to EGFR-Targeted Therapy in Head and Neck Squamous Cell Carcinoma.
Yoshikawa M, Tsuchihashi K, Ishimoto T, Yae T, Motohara T, Sugihara E, Onishi N, Masuko T, Yoshizawa K, Kawashiri S, Mukai M, Asoda S, Kawana H, Nakagawa T, Saya H, Nagano O.
Cancer Res. 2013 Mar 15;73(6):1855-1866. Epub 2013 Jan 14.
http://cancerres.aacrjournals.org/content/73/6/1855.abstract![]()
Alternative splicing of CD44 mRNA by ESRP1 enhances lung colonization of metastatic cancer cell.
Yae T, Tsuchihashi K, Ishimoto T, Motohara T, Yoshikawa M, Yoshida GJ, Wada T, Masuko T, Mogushi K, Tanaka H, Osawa T, Kanki Y, Minami T, Aburatani H, Ohmura M, Kubo A, Suematsu M, Takahashi K, Saya H, Nagano O.
Nat Commun. 2012 Jun 6;3:883. doi: 10.1038/ncomms1892.
http://www.nature.com/ncomms/journal/v3/n6/abs/ncomms1892.html![]()
CD44 variant regulates redox status in cancer cells by stabilizing the xCT subunit of system xc(-) and thereby promotes tumor growth.
Ishimoto T, Nagano O, Yae T, Tamada M, Motohara T, Oshima H, Oshima M, Ikeda T, Asaba R, Yagi H, Masuko T, Shimizu T, Ishikawa T, Kai K, Takahashi E, Imamura Y, Baba Y, Ohmura M, Suematsu M, Baba H, Saya H.
Cancer Cell. 2011 Mar 8;19(3):387-400. doi: 10.1016/j.ccr.2011.01.038.
http://www.sciencedirect.com/science/article/pii/S153561081100050X![]()

永野 修
(先端医科学研究所遺伝子制御研究部門 学部内講師)

左から:永野 修、佐谷秀行(教授)、石本崇胤(当時、共同研究員;
現在、熊本大学大学院生命科学研究特任助教)
バックは私たちの研究内容が採用されたCancer Cell (v.19, no.3, 2011)の表紙
最終更新日:2013年6月1日
記事作成日:2013年6月1日